В першій статті ми розглянули методи візуалізації та виклики, які часто виникають перед дослідниками. Нижче поговоримо про експерименти та їхні результати.
1. Короткочасний експеримент із швидкими подіями
Клітини U2OS були пофарбовані двома різними флуоресцентними барвниками, що позначають ту саму структуру, WGA-Alexa488 і WGA-Alexa555, обидва зв’язуються з клітинними мембранами. Знявши обидва канали на Mica в послідовному режимі, таке налаштування експерименту дає змогу ввести штучний часовий зсув між отриманням WGA-Alexa488 (зелений) і WGA-Alexa555 (червоний). З його допомогою однакові мембранні структури, які позначені двома різними барвниками Alexa, зображуються у двох мінімально зміщених точках часу. Порівнюючи обидва методи, ви можете побачити, що в той час як під час одночасного запису всі везикули жовті – суміш зеленого та червоного – у послідовному записі деякі везикули, що швидко рухаються, виглядають як дві різні структури – одна зелена та одна червона везикула.
Відео 1: Клітини U2OS, пофарбовані WGA-Alexa488 (зелений), WGA-Alexa555 (червоний). Канали флуоресценції знімали послідовно. Ви можете побачити просторово-часові невідповідності, які можна ідентифікувати за зеленими та червоними сигналами, що походять від однієї структури. Масштабна шкала = 5 мкм.
Відео 2: Клітини U2OS, позначені WGA-Alexa 488 (зелений), WGA-Alexa 555 (червоний). Канали флуоресценції знімали одночасно. Масштабна шкала = 5 мкм.
2. Експеримент середньої тривалості
Рибка даніо-реріо є модельним організмом, який дуже часто використовують для вивчення росту і розвитку організму. У цьому прикладі цікаво було вивчити координацію клітин у просторі, на яку впливає в’язкість навколишньої тканини. Два канали знімалися протягом 24 годин у режимі THUNDER із технологією Large Volume Computational Clearing (LVCC), щоб отримати більше деталей.
Відео 3: Ембріон рибки даніо-реріо в стані росту, виділяє признак майбутньої мезодерми (Tbxta:GFP; зелений). Міжклітинна рідина була позначена Dextran-Alexa647 (червоний). Z-стак із 25 шарів і загальною товщиною 250 мкм був отриманий з об’єктивом 10x/0.32 під час тайм-лапс зйомки протягом 24 годин. Інтервал часу становив 15 хвилин. Використовувався THUNDER Large Volume Computational Clearing (LVCC). Надано Камілою Ауторіно, Група Петріду, Європейська молекулярно-біологічна лабораторія Гайдельберг (Німеччина).
3. Тривалі експерименти
Клітини MDCK — це поляризовані епітеліальні клітини, які розвиваються у так звані цисти, якщо їх культивувати у матриці, такій як Matrigel®. Ці тривимірні структури можна використовувати для вивчення процесів розвитку та основних механізмів транспорту білка. Тут клітини були стабільно трансфіковані зв’язуючим білком мікротрубочок, пов’язаним із GFP, та які інкубували у Mica загалом протягом 3 тижнів.
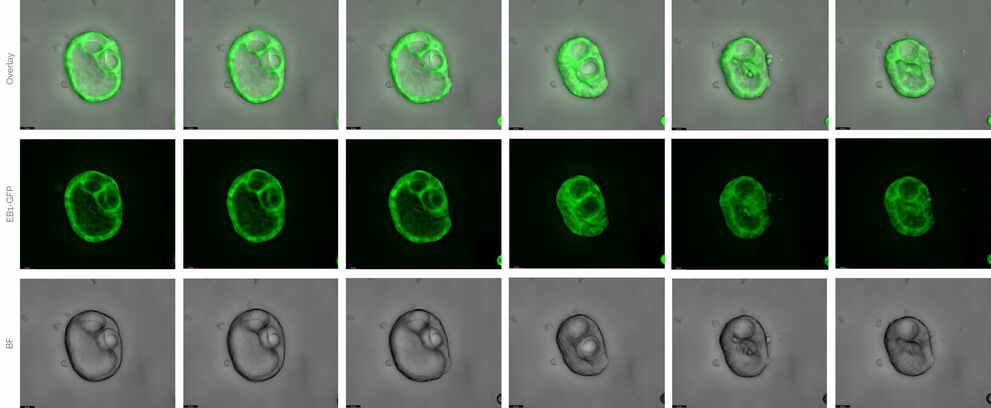
Рисунок 3: Кісти MDCK. Витяг 3-тижневого експерименту з живими клітинами. Часовий інтервал становив 6 годин. Розширена глибина різкості (EDOF). Верх: накладання шарів. Посередині: EB1-GFP. Знизу: широкопольова мікроскопія. THUNDER Large Volume Computational Clearing (LVCC). Масштабна шкала 20 мкм. Надано професором Ральфом Якобом і Мануелем Мюллером, Університет Філіпса, Марбург, Німеччина.
Після 9 днів розвитку деякі зі згаданих вище кіст були пофарбовані барвниками для живих клітин для візуалізації актину, тубуліну та мітохондрій на додаток до GFP-міченого зв’язуючого білка мікротрубочок. Згодом кісти візуалізували в конфокальному режимі.
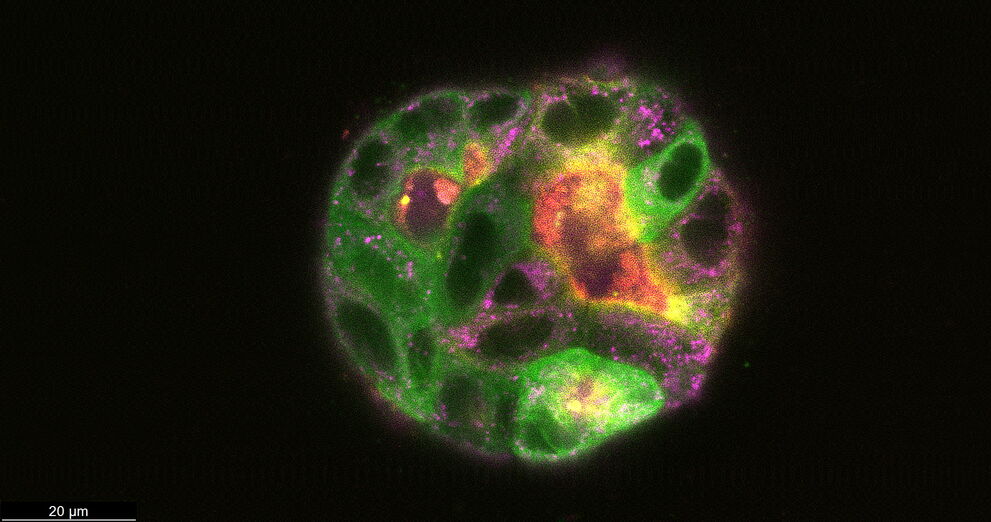
Рисунок 4: Кісти MDCK (CLSM) на 9 день. Деякі кісти були пофарбовані Mito-Blue (пурпуровий), SiR-Actin (червоний) і Tubulin-SPY555 (жовтий), на додаток до EB1-GFP (зелений) і зображено в конфокальному режимі за допомогою об’єктива 63x/1.20. Масштабна шкала = 20 мкм. Зразок надано професором Ральфом Якобом і Мануелем Мюллером, Університет Філіпса, Марбург, Німеччина.
Кістоподібні структури також можуть утворюватися шляхом культивування клітин у U-лункових планшетах. У цьому експерименті клітини MDCK культивували та записували на Mica з 1-го дня у світлому полі та широкопольовій флуоресценції для вивчення утворення кіст. Властивості інкубатора Mica дозволяли клітинам залишатися щасливими протягом кількох днів, поки вони перетворювалися на кістоподібні структури.
Відео 4: Утворення кісти знімалося протягом трьох днів за допомогою об’єктива 10x/0.32, каналів GFP і світлого поля та тайм-лапсом з 30-хвилинними інтервалами. Масштаб = 200 мкм.
Після 14 днів культивування кісти були зображені в конфокальному режимі при малому збільшенні, щоб ідентифікувати цікаву одиночну кісту. Огляд зразка – у цьому випадку 96-лункового планшета – для правильного місця для подальшого дослідження може бути громіздким. Інструмент Navigator допоміг тут зберегти огляд зразка та легко перейти до відповідних областей інтересу.
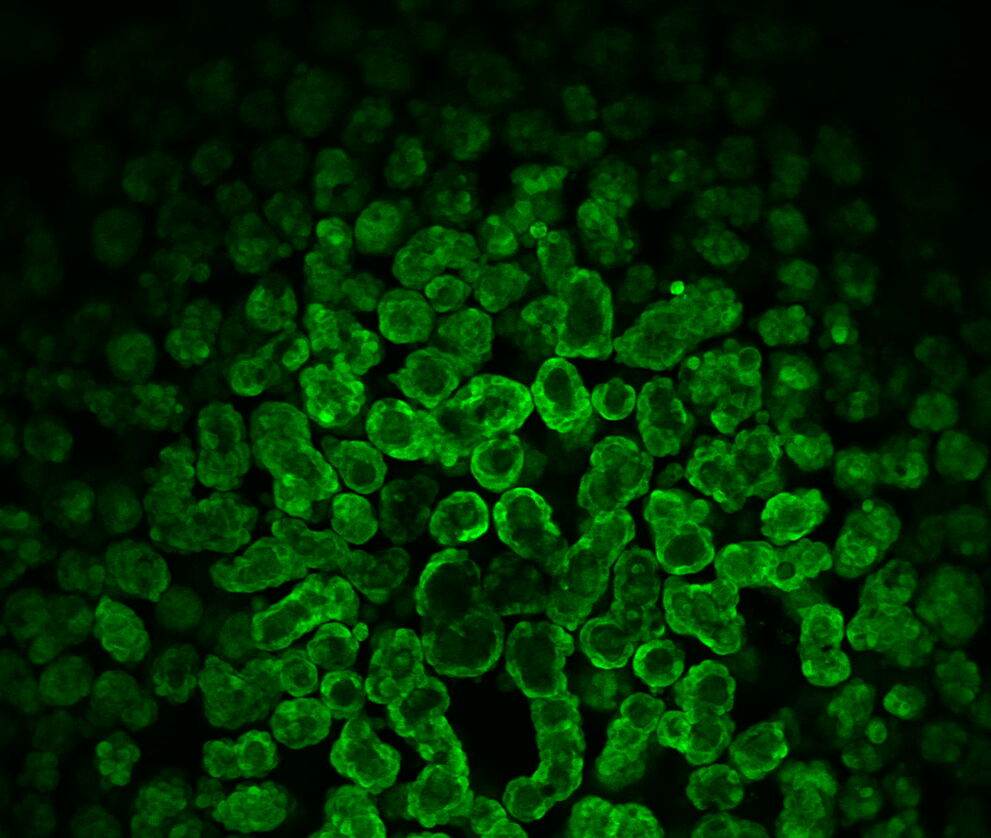
Рисунок 5: Огляд 14-денних кіст (CLSM) з об’єктивом 10x/0.32 і каналом GFP.
Потім одну з кіст було знято більш детально за допомогою об’єктива 63x у конфокальному режимі з LIGHTNING. Імерсія для водяного об’єктива 63x/1.20 подавалася автоматично та оптимізована для зразка за допомогою SmartCORR. Відео 5 демонструє порівняння отриманих об’ємних зображень просто в конфокальному режимі та додатково оброблених за допомогою LIGHTNING.
Відео 5: Одиночна 14-денна кіста (CLSM) знята на об’єктив 63x/1.20 з водяною імерсією у конфокальному режимі (зліва) і оброблених за допомогою LIGHTNING (праворуч). Z-стек із 285 шарів і товщиною 57 мкм був отриманий і реконструйований у 3D.
Читайте також: Початок епохи Microhub: нова розробка Leica Microsystems
Висновки
Mica добре адаптована для візуалізації живих клітин, що допомагає користувачам отримувати надійні результати від швидких, короткочасних експериментів до довготривалих, що проводяться тижнями: вбудована інкубаційна система забезпечує фізіологічні умови щодо температури та рН, що дозволяє проводити експерименти з живими клітинами тижнями. Крім того, рівень кисню можна контролювати, щоб отримати більш значущі дані. Технологія FluoSync™ дозволяє отримувати зображення до чотирьох флуорофорів одночасно, що в свою чергу означає, що швидкі клітинні події можуть бути зображені з абсолютною просторово-часовою кореляцією. Крім того, FluoSync™ зменшує інтервали між записаними багатобарвними зображеннями і, таким чином, покращує часову роздільну здатність. THUNDER і LIGHTNING допомагають користувачам витягнути більше деталей із зразка, тоді як автоматизовані процеси, такі як OneTouch для освітлення та автоматизована подача водяної імерсії, надають можливість працювати усім користувачам, навіть з мінімальною підготовкою та обмеженою технічною освітою.


