В первой статье мы рассмотрели методы визуализации и вызовы, которые возникают перед исследованиями. Ниже поговорим о экспериментах и результатах.
1. Кратковременный эксперимент с быстрыми событиями
Клетки U2OS были окрашены двумя разными флуоресцентными красителями, обозначающими ту же структуру, WGA-Alexa488 и WGA-Alexa555, оба связываются с клеточными мембранами. Сняв оба канала на Mica в последовательном режиме, такая настройка эксперимента позволяет ввести искусственное временное смещение между получением WGA-Alexa488 (зеленый) и WGA-Alexa555 (красный). С его помощью одинаковые мембранные структуры, обозначенные двумя разными красителями Alexa, изображаются в двух минимально смещенных точках времени. Сравнивая оба метода, вы можете увидеть, что в то время как во время одновременной записи все везикулы желтые – смесь зеленого и красного – в последовательной записи некоторые быстро движущиеся везикулы выглядят как две разные структуры – одна зеленая и одна красная везикула.
Видео 1: Клетки U2OS, окрашенные WGA-Alexa488 (зеленый), WGA-Alexa555 (красный). Каналы флуоресценции снимались последовательно. Вы можете увидеть пространственно-временные несоответствия, которые можно идентифицировать по зеленым и красным сигналам от одной структуры. Масштабная шкала = 5 мкм.
Видео 2: Клетки U2OS, обозначенные WGA-Alexa 488 (зеленый), WGA-Alexa 555 (красный). Каналы флуоресценции снимали одновременно. Масштабная шкала = 5 мкм.
2. Эксперимент средней длительности
Рыбка данио-рерио является модельным организмом, который часто используют для изучения роста и развития организма. В этом примере интересно было изучить координацию клеток в пространстве, на которое влияет вязкость окружающей ткани. Два канала снимались в течение 24 часов в режиме THUNDER с технологией Large Volume Computational Clearing (LVCC), чтобы получить больше деталей.
Видео 3: Эмбрион рыбки данио-рерио в состоянии роста, выделяет признак будущей мезодермы (Tbxta: GFP; зеленый). Межклеточная жидкость была обозначена Dextran-Alexa647 (красный). Z-стак из 25 слоев и общей толщиной 250 мкм был получен с объективом 10x/0.32 во время тайм-лапса съемки в течение 24 часов. Интервал времени составил 15 минут. Использовался THUNDER Large Volume Computational Clearing (LVCC). Предоставлена Камилой Ауторино, Группа Петрида, Европейская молекулярно-биологическая лаборатория Гайдельберг (Германия).
3. Длительные эксперименты
Клетки MDCK – это поляризованные эпителиальные клетки, которые развиваются в так называемые цисты, если их культивировать в матрице, такой как Matrigel®. Эти трехмерные структуры могут использоваться для изучения процессов развития и основных механизмов транспорта белка. Здесь клетки были стабильно трансфицированы связующим белком микротрубочек, связанным с GFP, и инкубировали в Mica в течение 3 недель.
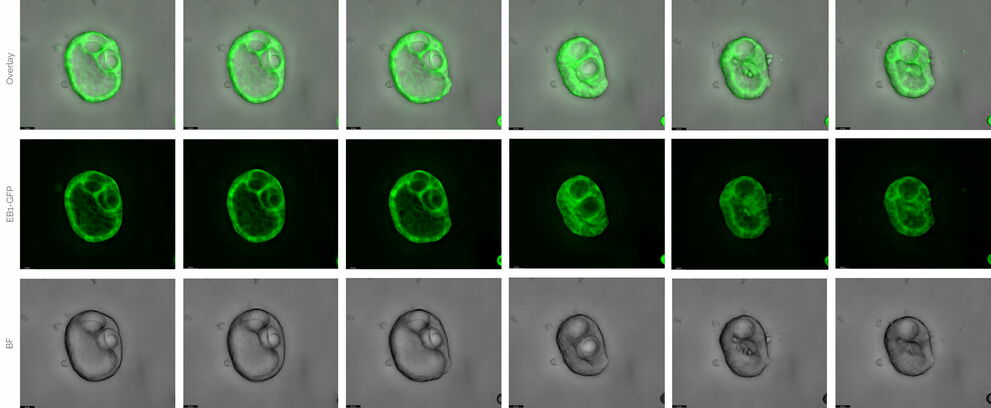
Рисунок 3: Кисты MDCK. Извлечение 3-недельного эксперимента с живыми клетками. Временной интервал составлял 6 часов. Расширенная глубина резкости (EDOF). Верх: наложение слоев. Посредине: EB1-GFP. Снизу: широкопольная микроскопия. THUNDER Большой Volume Computational Clearing (LVCC). Масштабная шкала – 20 мкм. Предоставлен профессором Ральфом Якобом и Мануэлем Мюллером, Университет Филипса, Марбург, Германия.
После 9 дней развития некоторые из упомянутых кист были окрашены красителями для живых клеток для визуализации актина, тубулина и митохондрий в дополнение к GFP-меченого связующего белка микротрубочек. Затем кисты визуализировали в конфокальном режиме.
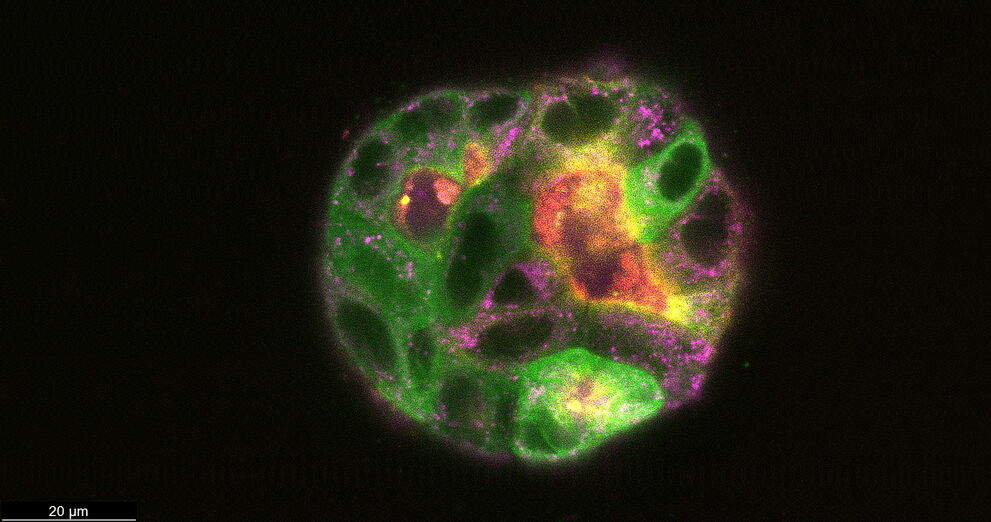
Рисунок 4: Кисты MDCK (CLSM) на 9 день. Некоторые кисты были окрашены Mito-Blue (пурпурный), SiR-Actin (красный) и Tubulin-SPY555 (желтый), в дополнение к EB1-GFP (зеленый) и изображены в конфокальном режиме с помощью объектива 63x/1.20. Масштабная шкала = 20 мкм. Образец предоставлен профессором Ральфом Якобом и Мануэлем Мюллером, Университет Филипса, Марбург, Германия.
Кистообразные структуры также могут образовываться путем культивирования клеток в U-луночных планшетах. В этом эксперименте клетки MDCK культивировали и записывали на Mica с 1 дня в светлом поле и широкополой флуоресценции для изучения образования кист. Свойства инкубатора Mica позволяли клеткам оставаться счастливыми в течение нескольких дней, пока они не превращались в кистообразные структуры.
Видео 4: Образование кисты снималось в течение трех дней с помощью объектива 10x/0.32, каналов GFP и светлого поля и тайм-лапсом с 30-минутными интервалами. Масштаб = 200 мкм.
После 14 дней культивирования кисты были изображены в конфокальном режиме при малом приращении, чтобы идентифицировать интересную одиночную кисту. Обзор образца – в этом случае 96-луночного планшета – для правильного места для дальнейшего исследования может быть громоздким. Инструмент Navigator помог здесь сохранить обзор образца и легко перейти в соответствующие области интереса.
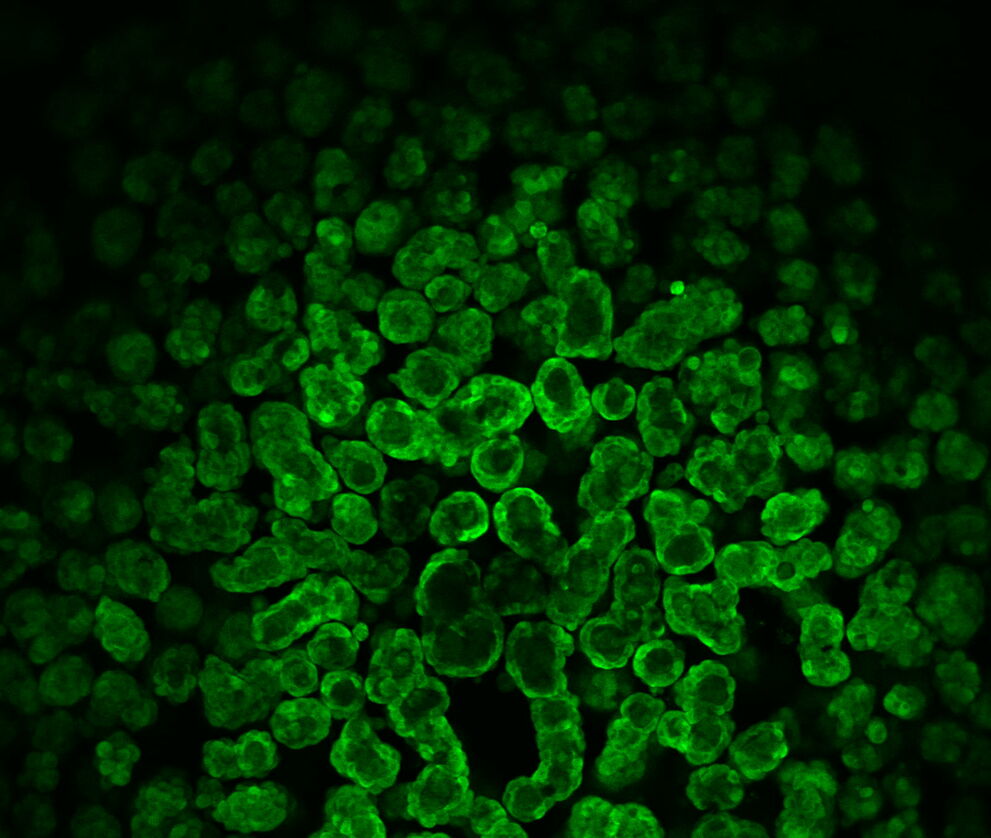
Рисунок 5: Обзор 14-дневных кист (CLSM) с объективом 10x/0.32 и каналом GFP.
Затем одна из кист была снята более подробно с помощью объектива 63x в конфокальном режиме с LIGHTNING. Имерсия для водяного объектива 63x/1.20 подавалась автоматически и оптимизирована для образца с помощью SmartCORR. Видео 5 демонстрирует сравнение полученных объемных изображений прямо в конфокальном режиме и дополнительно обработанных с помощью LIGHTNING.
Видео 5: Одиночная 14-дневная киста (CLSM) снята на объектив 63x/1.20 с водяной иммерсией в конфокальном режиме (слева) и обработанных с помощью LIGHTNING (справа). Z-стек из 285 слоев и толщиной 57 мкм был получен и реконструирован в 3D.
Читайте также: Начало эпохи Microhub: новая разработка Leica Microsystems
Заключение
Mica хорошо адаптирована для визуализации живых клеток, что помогает пользователям получать надежные результаты от быстрых и кратковременных экспериментов до длительных, проводимых неделями: встроенная инкубационная система обеспечивает физиологические условия температуры и рН, что позволяет проводить эксперименты с живыми клетками неделями. Кроме того, уровень кислорода можно контролировать для получения более значимых данных. Технология FluoSync™ позволяет получать изображения до четырех флуорофоров одновременно, что означает, что быстрые клеточные события могут быть изображены с абсолютной пространственно-временной корреляцией. Кроме того, FluoSync™ уменьшает интервалы между записанными многоцветными изображениями и улучшает временное разрешение. THUNDER и LIGHTNING помогают пользователям извлечь больше деталей из образца, в то время как автоматизированные процессы, такие как OneTouch для освещения и автоматизированная подача водной иммерсии, позволяют работать всем пользователям, даже с минимальной подготовкой и ограниченным техническим образованием.


