В даній статті розкажемо, як Mica допомагає користувачам вивчати живі клітини. Частина перша присвячена самому поняттю візуалізації та її методам, а також викликам, з якими можуть зіткнутися дослідники.
За допомогою зображень живих клітин дослідники отримують уявлення про динамічні процеси живих клітин і цілих організмів. Це включає як внутрішньоклітинну, так і міжклітинну діяльність.
Перенесення білків чи ліпідів, міграція імунних клітин, клітинна структура органоїдів чи розвиток тварин — лише кілька прикладів. Візуалізація живих клітин вимагає, щоб зразок і система мікроскопа мали певні властивості. У цій статті ми описуємо конкретні адаптації Mica до цих передумов і наводимо відповідні приклади.
Візуалізація живих клітин
Візуалізація живих клітин дозволяє отримати інформацію про біологічні процеси на мікроскопічному рівні. А для цього треба, щоб зразок містився в умовах, близьких до фізіологічних. Деякі з них згадані в абзаці нижче. Типовими зразками є класичні культури клітин, живі тканини, органоїди чи модельні організми. Зазвичай зразок досліджують за допомогою флуоресцентної мікроскопії. Для цього клітини трансфікують та отримують трансгенні організми, що експресують флуоресцентно мічені білки. Крім того, можна використовувати барвники для живих клітин.
Читайте також: Початок епохи Microhub: нова розробка Leica Microsystems
Виклики
1.Умови середовища.
Умови візуалізації живих клітин мають імітувати фізіологічне середовище задля досягнення максимально реалістичних експериментальних результатів. Оптимальні фізіологічні умови – температура, pH, рівень кисню – різняться між організмами. У той час як клітини ссавців вимагають ~37°C, клітини комах найкраще ростуть при ~27°C, риби віддають перевагу 28°C, а ділення дріжджів відбувається при ~30°C.
Рівень рН середовища клітинної культури постійно підтримується на рівні 7,0 – 7,4 за допомогою бікарбонатно-натрієвого буфера, що потребує наявності СО2 в атмосфері інкубатора. Крім того, атмосфера інкубатора має бути насичена водою, щоб культуральне середовище не випаровувалося.
Рівень кисню in vivo варіюється в залежності від тканин та типів клітин. Цікаво, що в даний час оксигенація не широко розглядається для інкубаторів клітинних культур та візуалізації живих клітин. Знижені рівні кисню можуть призвести, серед іншого, до зниження швидкості проліферації (гіпероксія) або зниження швидкості метаболізму (гіпоксія).
Ще одна складність для візуалізації живих клітин – це захист від світла, оскільки вплив світла може впливати на живі клітини як такі, а також на флуорофори. Наприклад, високі дози світла можуть призвести до пошкодження ДНК або фотознебарвлення флуорофорів.
Mica була розроблена, щоб впоратися з усіма цими проблемами.
Сам корпус виконує роль інкубатора. Це означає, що весь об’єм навколо зразка нагрівається до необхідної температури (в діапазоні від кімнатної температури плюс 5 °C до 42 °C) і врівноважується до бажаного рівня CO2 і вологості.
За бажанням рівень O2 контролюється в додатковій верхній камері. Усі параметри можна контролювати за допомогою програмного забезпечення Mica LAS X. Освітлення зразка встановлюється функцією OneTouch і може бути налаштовано за допомогою повзунка «Захист зразка – якість зображення», щоб збалансувати необхідну кількість сигналу та захист живих клітин і флуорофорів.
Для доступу до зразка з мінімальним порушенням навколишнього середовища, у передній кришці є невелике робоче віконце, яке можна відсунути.

Рисунок 1. Mica — інкубатор. Весь об’єм під кришкою врівноважується до бажаної температури, вологості та концентрації CO2. Для швидкого огляду зразків або взаємодії передню кришку можна опустити вниз, а невелике віконце відсунути.
2. Світло може бути токсичним.
Оскільки світло – це енергія, яку ви вносите в зразок, воно може мати негативні наслідки. Не тільки ультрафіолетове світло, яке, наприклад, може бути шкідливим для шкіри, будь-яке світло може заважати молекулам усередині клітини. Крім того, флуорофори можуть утворювати радикали, які взаємодіють з молекулами. Негативний вплив світла відомий як фототоксичність. Складність полягає в тому, щоб збалансувати кількість світла, необхідного для отримання достатнього сигналу, щоб відповісти на наукові питання, і мінімізувати фототоксичність. Mica допомагає користувачам у цьому, пропонуючи інструмент балансування саме цих двох речей для користувачів без технічної підготовки – повзунок між захистом та якістю. Одним кліком, OneTouch налаштує всі параметри збудження та детекції відповідно до вибору, зробленого на повзунку.
Внутрішньоклітинна динаміка може бути дуже швидкою. Наприклад, молекулярні двигуни, які несуть органели або везикули, досягають швидкості до кількох мкм/с. Це впливає на вимоги до отримання зображень, особливо коли потрібно отримати зображення більш ніж одним флуорофором. Проблема тут полягає в тому, що біологія не зупиняється для всіх флуоресцентних каналів, щоб їх можна було отримати в ідентичному стані, а постійно прогресує. У класичній системі на основі флуоресцентного фільтра найбільш трудомістким етапом є зміна кубів фільтра для різних каналів. Це призводить до того, що два флуорофори контролюються в два різні моменти часу в експерименті, унеможливлюючи точну просторово-часову кореляцію.
Технологія Mica FluoSync™ дозволяє користувачам отримувати до чотирьох каналів флуоресценції одночасно. Це означає, що різні везикули завантажені речовинами, цитоскелет і моторні білки можуть бути зображені зі 100% просторово-часовою кореляцією. Крім того, одночасне отримання даних забезпечує швидшу зміну часових точок зображення, таким чином, швидкі рухи клітин можна записати з вищою роздільною здатністю.
3. Запис великої кількості повторень із заданим інтервалом часу.
Запис великої кількості повторень у межах одного експерименту може бути складним завданням. Якщо припустити, що користувач хоче записувати кожні 10 хвилин, кількість позицій, які можна записати до початку наступного циклу, обмежена. Зазвичай це обмеження посилюється, якщо ви хочете записати кілька флуоресцентних міток в одну й ту саму позицію, але з Mica це не так. Технологія FluoSync™ дозволяє користувачам записувати до чотирьох разів швидше, тому що одночасно отримує до чотирьох міток, що дає користувачам більше часу для запису більшої кількості позицій. Користувачам більше не потрібно обирати між кількістю міток та кількістю позицій.
4. Пошук правильних позицій для зображення.
Пошук та проведення експерименту в потрібному місці на зразку може бути складним завданням. Використовуючи окуляри, потрібно притримуватися уявної карти зразка та запам’ятовувати окремі положення. Використання цифрового мікроскопа для створення огляду зразка може допомогти, але все ж таки необхідно вказати місце на зображенні, яке призначене для подальшої візуалізації. Mica пропонує спосіб спростити це за допомогою інструменту Navigator. Огляди зразка при меншому або більшому збільшенні допомагають користувачам знайти цікаві місця. Ці області інтересу можуть бути безпосередньо позначені вбудованим інструментом для малювання на зображеннях. Таким чином, контекст наступного зображення з високою роздільною здатністю може бути збережений.
5. Вибір правильного об’єктива для візуалізації живих клітин
Оскільки візуалізація живих клітин зазвичай виконується у водних розчинах, об’єктиви із великим збільшенням призначені для використання води як імерсійного середовища, оскільки вона відповідає оптичним властивостям середовища. Розмістити воду між об’єктивом і зразком буває складно і це може призвести до зміни фокусу та положення зразка. Крім того, вода може досить швидко випаровуватися, тому її потрібно постійно поповнювати. Mica має вбудовану систему зворотного зв’язку, щоб спочатку розмістити водяну імерсію, а потім підтримувати занурення у воду під час використання такого об’єктива. Цей підхід дозволяє уникнути ручних дій та дозволяє довгострокові експерименти.
Для подальшого підвищення оптичної якості деякі об’єктиви мають кільце CORRring для компенсації товщини носія зразка. CORRring може потребувати ручного або моторизованого керування. Завдяки функції SmartCORR оптимізація виконується автоматично за допомогою Mica.
6. Відслідковування впливу окремих змінних.
Одним із ключових аспектів наукових експериментів є зміна якнайменшого числа змінних, щоб точно визначити вплив на зразок та результати. Це включає застосування одного і того ж набору умов візуалізації у всіх експериментах. Одним із аспектів є стабільні умови навколишнього середовища (температура, pH та O2, див. також вище). Наступним важливим аспектом є однакові параметри візуалізації (збудження та детекція). Mica за замовчуванням зберігає параметри зображення постійними у проектах та змінює їх лише за бажанням користувачів. Параметри зображення можна відновити з еталонних зображень. З погляду умов навколишнього середовища, Mica – це повноцінний інкубатор. Умови стабільні, щоб забезпечити зростання кіст MDCK (клітини собачої нирка Мадіна-Дарбі) протягом 3 тижнів поспіль (див. також нижче).
Методи
Mica має спеціальні тримачі зразків для зображення живих клітин. Сюди входять тримачі для малих (36 мм) і середніх (60 мм) чашок Петрі.

Рисунок 2: Тримачі зразків для зображення живих клітин. Доступні тримачі для чашок Петрі різних розмірів. Зображення живих клітин також можна зробити за допомогою класичного тримача предметних скелець (не показано), наприклад, використовуючи скельця ibidi µ-Slide 8 Well.
1. Везикули.
Клітини U2OS одночасно фарбували WGA-Alexa488 і WGA-Alexa555. Обидва барвники накопичуються на плазматичній мембрані та всіх везикулах і ендосомах клітини. Флуорофори знімали або одночасно, або послідовно для порівняння. Середовище було налаштовано таким чином, щоб підтримувати постійні 37 °C і 5% CO2, а отже, фізіологічні рівні pH.
Для отримання зображень із великим збільшенням використовувався об’єктив 63x/1.20 з водяною імерсією і автоматичним зануренням. Ніякої ручної взаємодії не було потрібно.
2. Рибка даніо-реріо (zebrafish).
Зображена нижче лінія риби (Danio rerio) це трансгенна лінія, що показує майбутню мезодерму (Tbxta:GFP). Для цього експерименту проводили зйомку розвитку ембріона від стадії сфери до стадії соміту. Міжтканинну рідину фарбували Dextran-Alexa647. Ембріон зберігали при 28°С.
3. Кісти.
а) Клітини MDCK, стабільно трансфіковані EB1-GFP, вирощували в Matrigel® для індукції росту кіст на 8-лункових предметних скельцях ibidi µ-Slide 8 Well. Навколишнє середовище було налаштовано на підтримку постійної температури 37 °C, 5% CO2 та високої вологості.
На 2-й день клітини демонстрували об’ємні 3D конгломерати і були дуже рухомими всередині Matrigel®.
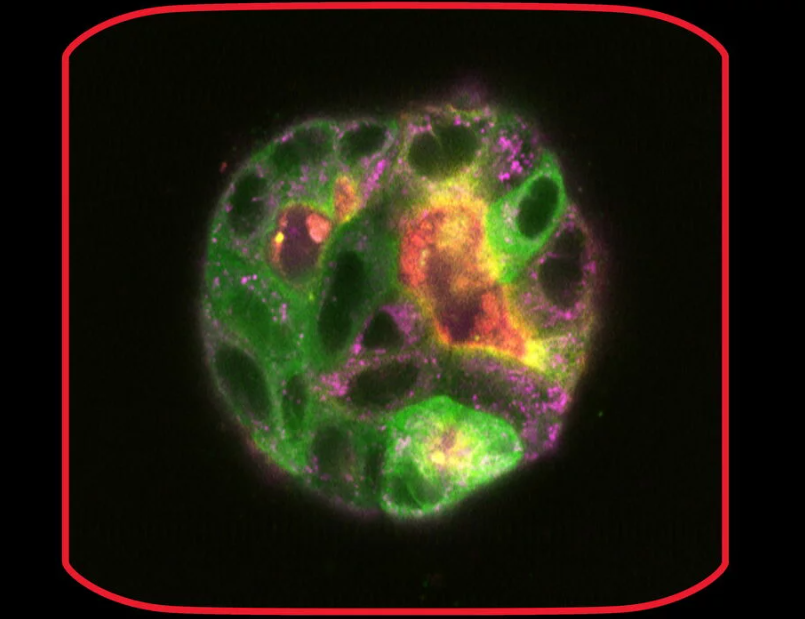
На 9-й день кісти залишалися відносно стабільними та були зняті при великому збільшенні (63x) у стаціонарному стані та протягом часу (6 днів та 6-годинний часовий інтервал у GFP та IMC (модуляційний контраст для світлопольної візуалізації). 3D зйомка дозволила отримати 3D -відбиток кіст (418 шарів з інтервалом 220.7 нм, загальний розмір висоти Z-стак 92.02 мкм). На 9-й день деякі кісти були пофарбовані з Mito-Blue, SiR-Actin, і Tubulin-SPY555, на додаток до EB1-GFP.
b) 5000 клітин MDCK, стабільно трансфікованих EB1-GFP, вирощували в планшетах з U-лунками. Цікаво, що ці клітини також утворювали цистоподібні структури вже за кілька днів. Одна з цих кістоподібних структур була додатково досліджена у конфокальному режимі для тривимірної реконструкції.
Про проведені експерименти та їхні результати читайте в продовженні
