В данной статье расскажем, как Mica помогает пользователям изучать живые клетки. Часть первая посвящена понятию визуализации и ее методам, а также вызовам, с которыми могут столкнуться исследователи.
С помощью изображений живых клеток исследователи получают представление о динамических процессах живых клеток и целых организмов. Это включает как внутриклеточную, так и межклеточную деятельность.
Перенос белков или липидов, миграция иммунных клеток, клеточная структура органоидов или развитие животных — всего несколько примеров. Визуализация живых клеток требует, чтобы образец и система микроскопа обладали определенными свойствами. В этой статье мы описываем конкретные адаптации Mica к этим предпосылкам и приводим соответствующие примеры.
Визуализация живых клеток
Визуализация живых клеток позволяет получить информацию о биологических процессах на микроскопическом уровне. А для этого нужно, чтобы образец содержался в условиях, близких к физиологическим. Некоторые из них упомянуты в абзаце ниже. Типичными образцами являются классические культуры клеток, живые ткани, органоиды или модельные организмы. Обычно образец исследуют с помощью флуоресцентной микроскопии. Для этого клетки трансфицируют и получают трансгенные организмы, экспрессирующие флуоресцентно меченые белки. Кроме того, можно использовать красители для живых клеток.
Читайте также: Начало эпохи Microhub: новая разработка Leica Microsystems
Вызовы
1. Условия среды.
Условия визуализации живых клеток должны имитировать физиологическую среду для достижения максимально реалистичных экспериментальных результатов. Оптимальные физиологические условия – температура, pH, уровень кислорода различаются между организмами. В то время как клетки млекопитающих требуют ~37°C, клетки насекомых лучше растут при ~27°C, рыбы предпочитают 28°C, а деление дрожжей происходит при ~30°C.
Уровень рН среды клеточной культуры постоянно поддерживается на уровне 7,0 – 7,4 с помощью бикарбонатно-натриевого буфера, нуждающегося в наличии СО2 в атмосфере инкубатора. Кроме того, атмосфера инкубатора должна быть насыщена водой, чтобы культуральная среда не испарялась.
Уровень кислорода in vivo варьируется в зависимости от тканей и типов клеток. Интересно, что в настоящее время оксигенация не обширно рассматривается для инкубаторов клеточных культур и визуализации живых клеток. Сниженные уровни кислорода могут привести, среди прочего, к снижению скорости пролиферации (гипероксия) или снижению скорости метаболизма (гипоксия).
Еще одна сложность для визуализации живых клеток – это защита от света, поскольку воздействие света может влиять на живые клетки как таковые, а также на флуорофоры. Например, высокие дозы света могут привести к повреждению ДНК или фотообесцвечиванию флуорофоров.
Mica была разработана, чтобы справиться со всеми этими проблемами.
Сам корпус играет роль инкубатора. Это означает, что весь объем вокруг образца нагревается до требуемой температуры (в диапазоне от комнатной температуры плюс 5 до 42 °C) и уравновешивается до желаемого уровня CO2 и влажности.
По желанию уровень O2 контролируется в дополнительной верхней камере. Все параметры можно контролировать с помощью программного обеспечения Mica LAS X. Освещение образца устанавливается функцией OneTouch и может быть сконфигурировано с помощью ползунка «Защита образца – качество изображения», чтобы сбалансировать необходимое количество сигнала и защиту живых клеток и флуорофоров.
Для доступа к образцу с минимальным нарушением окружающей среды в передней крышке имеется небольшое рабочее окошко, которое можно отодвинуть.

Рисунок 1. Mica — инкубатор. Весь объем под крышкой уравновешивается до желаемой температуры, влажности и концентрации CO2. Для быстрого просмотра образцов или взаимодействия переднюю крышку можно опустить вниз, а небольшое окошко отодвинуть.
2. Свет может быть токсичным.
Поскольку свет – это энергия, которую вы вносите в образец, он может иметь негативные последствия. Не только ультрафиолетовый свет, который, например, может быть вреден для кожи, любой свет может мешать молекулам внутри клетки. Кроме того, флуорофоры могут образовывать радикалы, взаимодействующие с молекулами. Негативное воздействие света известно как фототоксичность. Сложность состоит в том, чтобы сбалансировать количество света, необходимого для получения достаточного сигнала, чтобы ответить на научные вопросы и минимизировать фототоксичность. Mica помогает пользователям в этом, предлагая инструмент балансировки этих двух вещей для пользователей без технической подготовки – ползунок между защитой и качеством. Одним щелчком OneTouch настроит все параметры возбуждения и детекции в соответствии с выбором, сделанным на ползунке.
Внутриклеточная динамика может быть очень быстрой. Например, молекулярные двигатели, несущие органеллы или везикулы, достигают скорости до нескольких мкм/с. Это влияет на требования к получению изображений, особенно когда нужно получить изображение более чем одним флуорофором. Проблема здесь заключается в том, что биология не останавливается для всех флуоресцентных каналов, чтобы их можно получить в идентичном состоянии, а постоянно прогрессирует. В классической системе на основе флуоресцентного фильтра наиболее трудоемким этапом является изменение кубов фильтра для разных каналов. Это приводит к тому, что два флуорофора контролируются в два разных момента времени в эксперименте, исключая точную пространственно-временную корреляцию.
Технология Mica FluoSync™ позволяет пользователям получать до четырех каналов флуоресценции одновременно. Это означает, что различные везикулы загружены веществами, цитоскелеты и моторные белки могут быть изображены со 100% пространственно-временной корреляцией. Кроме того, одновременное получение данных обеспечивает более быстрое изменение временных точек изображения, таким образом, быстрые движения клеток можно записать с более высоким разрешением.
3. Запись большого количества повторов с заданным интервалом времени.
Запись большого количества повторений в рамках одного эксперимента может быть сложной задачей. Если предположить, что пользователь хочет записывать каждые 10 минут, количество позиций, которые можно записать до начала следующего цикла, ограничено. Обычно это ограничение усиливается, если вы хотите записать несколько флуоресцентных меток в одну и ту же позицию, но с Mica это не так. Технология FluoSync™ позволяет пользователям записывать до четырех раз быстрее, так как одновременно получает до четырех меток, что дает пользователям больше времени для записи большего количества позиций. Пользователям не нужно выбирать между количеством меток и количеством позиций.
4. Поиск правильных позиций для изображения.
Поиск и проведение эксперимента в нужном месте по образцу может быть сложной задачей. Используя очки, нужно придерживаться воображаемой карты образца и запоминать отдельные положения. Использование цифрового микроскопа для создания обзора образца может помочь, но все же необходимо указать место на изображении, предназначенном для дальнейшей визуализации. Mica предлагает способ упростить это с помощью инструмента Navigator. Обзоры образца при меньшем или большем увеличении помогают пользователям найти интересные места. Эти области интереса могут быть непосредственно отмечены встроенным инструментом для рисования на изображениях. Таким образом, контекст следующего изображения с высоким разрешением может быть сохранен.
5. Выбор правильного объектива для визуализации живых клеток.
Поскольку визуализация живых клеток обычно производится в водных растворах, объективы с большим увеличением предназначены для использования воды в качестве иммерсионной среды, поскольку она соответствует оптическим свойствам среды. Разместить воду между объективом и образцом бывает сложно и это может привести к изменению фокуса и положению образца. Кроме того, вода может достаточно быстро улетучиваться, поэтому ее нужно постоянно пополнять. Mica имеет встроенную систему обратной связи, чтобы сначала разместить водяную иммерсию, а затем поддерживать погружение в воду при использовании такого объектива. Этот подход позволяет избежать ручных действий и разрешает долгосрочные эксперименты.
Для повышения оптического качества некоторые объективы имеют кольцо CORRring для компенсации толщины носителя образца. CORRring может потребовать ручного или моторизированного управления. Благодаря функции SmartCORR оптимизация выполняется автоматически с помощью Mica.
6. Отслеживание влияния отдельных переменных.
Одним из ключевых аспектов научных экспериментов является изменение наименьшего числа переменных, чтобы точно определить влияние образца и результатов. Это включает применение одного и того же набора условий для визуализации во всех экспериментах. Одним из аспектов являются стабильные условия окружающей среды (температура, pH и O2, см. выше). Следующим важным аспектом являются одинаковые параметры визуализации (возбуждение и детекция). По умолчанию Mica сохраняет параметры изображения постоянными в проектах и изменяет их только по желанию пользователей. Параметры изображения можно восстановить из эталонных изображений. С точки зрения условий окружающей среды, Mica – это полноценный инкубатор. Условия стабильны, чтобы обеспечить рост кист MDCK (собачьей клетки почка Мадина-Дарби) в течение 3 недель подряд (см. также ниже).
Методы
Mica имеет специальные держатели образцов для изображения живых клеток. Сюда входят держатели для малых (36 мм) и средних (60 мм) чашек Петри.

Рисунок 2: Держатели образцов для изображения живых клеток. Доступные держатели для чашек Петри разных размеров. Изображение живых клеток также можно сделать с помощью классического держателя предметных стекол (не показано), например, используя стекла ibidi µ-Slide 8 Well.
1. Везикулы
Клетки U2OS одновременно окрашивали WGA-Alexa488 и WGA-Alexa555. Оба красителя накапливаются на плазматической мембране и на всех везикулах и эндосомах клетки. Флуорофоры снимали либо одновременно, либо последовательно для сравнения. Среда была настроена таким образом, чтобы поддерживать постоянные 37 С и 5% CO2, а следовательно, физиологические уровни pH.
Для получения изображений с большим увеличением использовался объектив 63x/1.20 с водяной иммерсией и автоматическим погружением. Никакого ручного взаимодействия не требовалось.
2. Рыбка данио-рерио (zebrafish).
Изображенная ниже линия рыбы (Danio rerio) – это трансгенная линия, показывающая будущую мезодерму (Tbxta:GFP). Для этого эксперимента производили съемку развития эмбриона от стадии сферы до стадии сомита. Межтканевую жидкость окрашивали Dextran-Alexa647. Эмбрион хранили при 28°С.
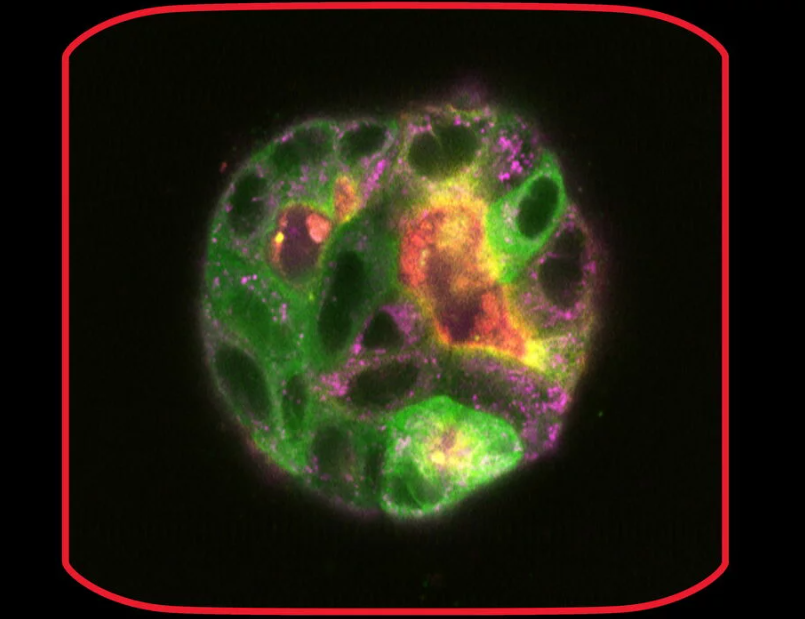
3. Кисты.
а) Клетки MDCK, стабильно трансфицированные EB1-GFP, выращивали в Matrigel® для индукции роста кист на 8-луночных предметных стеклах ibidi µ-Slide 8 Well. Окружающая среда была настроена для поддержания постоянной температуры 37 °C, 5% CO2 и высокой влажности. На 2-й день клетки демонстрировали объемные 3D конгломераты и были очень подвижны внутри Matrigel®.
На 9-й день кисты оставались относительно стабильными и были сняты при большом увеличении (63x) в стационарном состоянии и в течение времени (6 дней и 6-часовой интервал в GFP и IMC (модуляционный контраст для светопольной визуализации). 3D съемка позволила получить 3D -отпечаток кист (418 слоев с интервалом 220.7 нм, общий размер высоты Z-стак 92.02 мкм).
b) 5000 клеток MDCK, стабильно трансфицированных EB1-GFP, выращивали в планшетах с U-лунками. Интересно, что эти клетки также образовывали цистовидные структуры уже через несколько дней. Одна из этих кистообразных структур была дополнительно исследована в конфокальном режиме для трехмерной реконструкции.
О экспериментах, а также их результатах читайте в продолжении
