Глобалізація і зміна клімату призвели до швидкого поширення збудників різних захворювань – як вірусних, так і бактеріальних. За останні 10 років спалахи таких захворювань як лихоманка Західного Нілу, віруси Зіка, Чикунгунья, денге і низки інших, викликані відповідними збудниками, змусили світове трансфузіологічне співтовариство сфокусувати увагу на пошуку ефективних способів забезпечення безпеки компонентів донорської крові. У цій статті ми розповімо про те, з чим стикаються центри Служби крові в усьому світі, як вони вирішують питання з безпекою трансфузіологічних процедур і які рішення для цього використовують.
Бактеріальна безпека
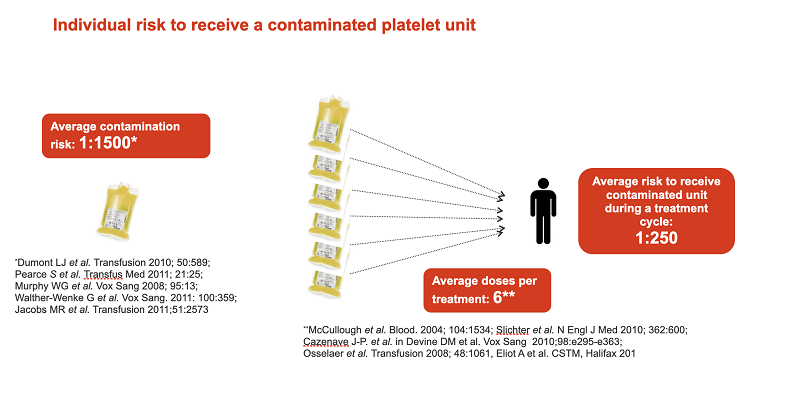
Яка ймовірність, що пацієнтові трапиться контамінований контейнер донорських тромбоцитів? Згідно з опублікованою статистикою, в середньому ймовірність отримати заражений патогенами компонент крові становить 1:1500. Тобто, у всьому світі 1 з 1500 пацієнтів заражається різними патогенами через переливання крові. Ризик збільшується, коли переливання компонентів донорської крові є частиною програми лікування. В середньому в процесі терапії пацієнт отримує 6 доз компонентів донорської крові. У цьому випадку ймовірність отримати заражений патогенами компонент крові істотно підвищується і становить приблизно 1:250.
Ключова проблема організації бактеріальної безпеки під час переливання крові в медичних установах полягає в тому, що зв’язок посттрансфузійного сепсису і бактеріальних інфекцій з донорськими тромбоцитами мало вивчений через недостатнє спостереження за реакціями пацієнтів після процедури. Разом з тим, активне вивчення проблеми в профільній науковій установі показало, що пацієнти, які отримують заражені донорські тромбоцити, мали септичні трансфузійні реакції.
Ризик бактеріальної контамінації донорської крові, особливо тромбоцитного концентрату, досить високий (від 1:2000). Відповідно, високою є і можливість посттрансфузійного бактеріального сепсису, який може призвести до летального результату. Одна з найбільш чутливих до бактеріальних патогенів група – онкогематологічні пацієнти, які отримують в складі терапії концентрати тромбоцитів. Трансфузія бактеріально контамінованих тромбоцитів в цьому випадку часто призводить до високого рівня інфекційних ускладнень, збільшення тривалості лікування і погіршення його результату.
Тестувати або інактивувати. Економічна доцільність
Глобалізація і глобальне потепління – фактори, які стали драйвером швидкого поширення збудників різних хвороб у всьому світі – як вірусних, так і бактеріальних. На відміну від бактерій, культуру яких можна виростити і ідентифікувати в лабораторії, для ідентифікації вірусу потрібен тест на нуклеїнові кислоти (NAT), який розроблений і орієнтований на виявлення конкретного, вже відомого вірусу. Сама розробка такого тесту під кожен новий, невідомий вірус – процес складний, тривалий за часом і дорогий. NAT-скринінг компонентів донорської крові, які використовуються для трансфузій, – це додаткові витрати для лабораторій центрів Служби крові.
Наприклад, необхідність тестувати компоненти донорської крові додатково на наявність вірусу, що викликає лихоманку Зіка, спалах якої було зафіксовано в США і Бразилії в 2016 році, обходиться Центрам крові США приблизно в 100 мільйонів доларів щорічно.
Скринінгові дослідження компонентів крові значно підвищили безпеку трансфузий для реципієнтів, але також збільшили витрати центрів переливання крові.
За результатами досліджень, опублікованих в рецензованому медичному журналі Vox Sanguinis, успішне впровадження технології ампліфікації нуклеїнових кислот (NAT) на ВІЛ, віруси гепатитів В і С в розвинених країнах дало змогу скоротити ризик трансфузійного інфікування до 1 випадку на 50 000 – 1 000 000 донаций.
Разом з тим, результати масштабного аналізу витрат на тестування компонентів донорської крові на згадані віруси в західних країнах показав, що використання навіть вже розроблених тестів для виявлення цих ідентифікованих вірусів пов’язане з великими витратами. Це робить компоненти донорської крові – протестовані і безпечні – менш доступними для пацієнта.
Спектр збудників, що передаються з компонентами донорської крові, постійно розширюється за рахунок цілої низки чинників, включаючи еволюцію самих збудників.
Сьогодні у фокусі уваги світової трансфузійної спільноти – арбовіруси, група вірусів, яка переноситься членистоногими. Лихоманка Західного Нілу, Віруси Зіка, Чикунгунья і денге – найбільш поширені з них. Арбовіруси потенційно небезпечні для безпеки компонентів крові з точки зору безсимптомної фази вірусемії у людини. Більшість видів арбовірусів не становлять загрози для Служби крові, бо для них людина – кінцевий господар, що не розвиває достатню вірусемію для інфікування. Лихоманка Західного Нілу, Віруси Зіка, Чикунгунья і денге – виняток. Вони і ще 130 інших видів можуть викликати хвороби у людини, спалахи яких відбуваються в міському середовищі. Зважаючи на це, дедалі частіше в науковому співтоваристві озвучуються аргументи на користь впровадження універсальної технології інактивації патогенів поряд з розробкою специфічних NAT-тестів.
Скринінгове обстеження донорів і NAT-тести – класичний реактивний підхід до трансфузійної медицини. Тобто, потенційна небезпека ідентифікується, медицина реагує, а далі – розробляються методи боротьби з цією потенційною небезпекою. Як вже відзначили, такий підхід витратний за часом і фінансами, що не дає змоги реагувати на усунення небезпеки швидко. Ситуація ускладнюється постійною появою нових вірусів, які можуть нести потенційну загрозу гемотрансмісивних інфекцій.
За даними експертів глобального проекту “Віром” (Virome), які займаються вивченням вірусів, існує приблизно 1,3 мільйона неідентифікованих вірусів. За їхніми оцінками, близько 500 тисяч з них, ймовірно, є зоонозними, тобто можуть передаватися від тварин людям. Тільки за останні 5 років вчені проекту виявили 820 нових вірусів, і вкрай важко сказати, які з цих вірусів вже живуть в організмах людей і тварин, як і передбачити, які захворювання в майбутньому вони можуть викликати. Оскільки віруси постійно еволюціонують і видозмінюються, розробка специфічних NAT під кожен новий вид для скринінгу донорів (і пов’язані з цим часові та фінансові витрати) може поставити під загрозу стабільність постачання компонентами донорської крові центрів Служб крові по всьому світу.
Технологія інактивації патогенів в компонентах донорської крові – це проактивний підхід до забезпечення безпеки трансфузійних процедур. Саме тому вона є ефективною альтернативою NAT-скринінгу. Інактивація патогенів орієнтована на усунення як відомих, так і невідомих вірусів і бактерій, і отримання на виході очищених і безпечних компонентів донорської крові. Це своєю чергою дає змогу виключити ризик зараження реципієнта, уникнути ускладнень після трансфузій і, головне, скоротити витрати на забезпечення безпеки компонентів донорської крові.
За оцінками клініцистів, переливання патогенінактивованих компонентів донорської крові дало змогу скоротити кількість посттрансфузійних реакцій на 30-90 відсотків. Згідно з даними, опублікованими в статті Американської асоціації банків крові, переливання патогенінактивованих тромбоцитів контрольній групі пацієнтів із 100 000 осіб по всьому світу пройшло без будь-яких серйозних посттрансфузійних реакцій.
Доказом ефективності патогенінактиваціі в порівнянні з NAT-скринінгом донорів може служити досвід Центру крові Валенсії (Іспанія). Центр використовує плазму, патогенредуковану метиленовим синім, а також карантинізовану плазму. Центр переливання крові Валенсії карантинізує плазму двома шляхами: пасивним (коли донор сам приходить на чергову донацію) і активним (донора викликають тільки для обстеження). Для оптимізації витрат Центр оцінив економічну ефективність використовуваних технологій за умови продажу для фракціонування всієї незатребуваної карантинізованої плазми. З’ясували наступне:
- У порівнянні з пасивною карантинізацією інактивація патогенів метиленовим синім збільшує витрати Центру на 850,4 тисячі євро (на 7,2 євро більше в розрахунку на 1 пацієнта), а в порівнянні з активною – призводить до суттєвої економії в розмірі 5,8 мільйона євро ( зниження витрат на 1 пацієнта в розмірі 50,4 євро) протягом 5 років.
- Інактивація патогенів метиленовим синім ефективніша за карантинізовану плазму за результатами всіх аналізів.
Технології інактивації патогенів
Всупереч широкому впровадженню NAT в обстеженні донорів, в розвинених країнах продовжують реєструвати випадки гемотрансмісивних заражень ВІЛ, гепатитами В і С. За прогнозами дослідників, приблизно кожні 5 років буде з’являтися як мінімум один новий патоген, що передається через переливання компонентів крові. Зважаючи на це, особлива увага центрів переливання крові має бути сфокусована на донорах-мандрівників, які повертаються з епідемічних регіонів.
Головний недолік реактивного підходу до забезпечення безпеки трансфузій в тому, що за відсутності NAT для тестування донора на специфічний патоген, єдиний можливий варіант дій – відведення донора. Така стратегія ставить під загрозу регулярне постачання клінік компонентами донорської крові. Подібного сценарію дає можливість уникнути технологія інактивації патогенів, універсальність і ефективність якої дозволяє замінити застосовувані нині реактивні заходи щодо забезпечення безпеки компонентів донорської крові.
Для інактивації патогенів застосовують 4 схвалених на сьогодні методи для плазми крові:
- метиленовий синій + видиме світло – використовують для підготовки окремих доз для трансфузії
- розчинник-детергент – застосовується в основному для промислового фракціонування
- амотосален в поєднанні з ультрафіолетовим випромінюванням з довжиною хвилі А – для інактивації аферезних доз до 650 мл
- рибофлавін в поєднанні з ультрафіолетовим світлом
Зазначені вище методи не призначені для інактивації патогенів в клітинних компонентах крові, оскільки вони сильно ушкоджують тромбоцити і еритроцити.
Для інактивації патогенів в концентратах клітин використовують технології, які лягли в основу двох розробок – Intercept компанії Cerus і Mirasol компанії Terumo BCT. Зупинимося на них детальніше.
Технологія INTERCEPT
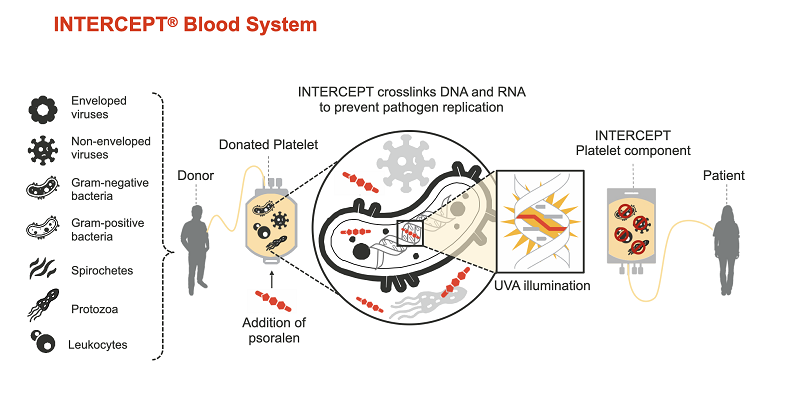
Intercept – технологія інактивації патогенів в клітинах крові, розроблена корпорацією Cerus (США). Вона базується на унікальній фотохімічній технології зв’язування нуклеїнових кислот: після забору аферезних тромбоцитів у донора, які імовірно містять патогени (бактерії або віруси), отриманий біоматеріал змішується з речовиною-інактиватором і обробляється ультрафіолетовим випромінюванням. Як речовина-інактиватор використовується синтетичний псорален S-59, який проникає крізь мембрани клітин і ядер і зв’язується з нуклеїновими кислотами. Далі, під впливом ультрафіолетового світла з довжиною хвилі А утворюються поперечні зв’язки нуклеїнових кислот і псоралена, пошкоджуються ДНК вірусів, бактерій та інших патогенів. Дію технології ретельно досліджували, і було відзначено високу частоту ковалентних зв’язків, які ефективно блокують реплікації, транскрипції і відновлення ДНК і РНК патогенів. Незв’язані псоралени і їхні фотопродукти прибирають за допомогою адсорбційного пристрою.
Технологія Mirasol
В технології Mirasol, розробленій компанією Terumo BCT (США), у ролі інактиватора використовується вітамін В2 (рибофлавін). Під впливом ультрафіолетового світла працює як фотосенсибілізатор і призводить до окислення нуклеїнових кислот, без зв’язування з ними або білками. В результаті рибофлавін перетворюється в люміхром і похідні фотопродукти. Технологія незворотно пошкоджує ДНК і РНК патогенів, пригнічує процес реплікації і механізми відновлення нуклеїнових кислот. Однак, за результатами випробувань, АФК, які генеруються технологією, негативно впливають на молекулярну цілісність лабільних факторів згортання крові.
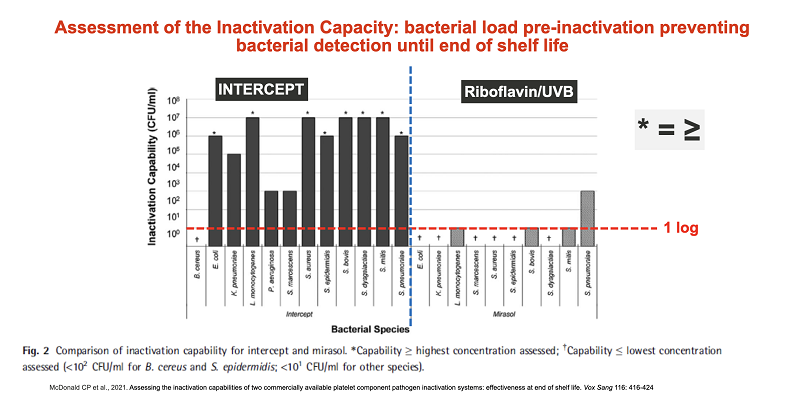
У лютому 2021 року у виданні Vox Sanguinis були опубліковані результати порівняльного аналізу ефективності технологій Intercept і Mirasol для інактивації патогенів в клітинах донорської крові. Дослідники оцінювали технології на підставі відсутності життєздатних бактерій в патогенінактивованих концентратах тромбоцитів наприкінці терміну їхнього зберігання. Результати порівняльного аналізу показали, що технологія Intercept ефективніше справляється із завданням інактивації патогенів та термін зберігання патогенінактивованого тромбоконцентрату за допомогою технології Intercept може бути збільшений з 5 до 7 днів.
Бажаєте дізнатися більше про систему для інактивації патогенів Інтерсепт? Заповніть, будь ласка, форму, і отримайте запис вебінару доктора Маркуса Пикарда-Моро, директора з питань науки в країнах Європи, Близького Сходу і Африки корпорації Cerus.