Глобализация и изменение климата привели к быстрому распространению возбудителей различных заболеваний — как вирусных, так и бактериальных. За последние 10 лет вспышки таких заболеваний как лихорадка Западного Нила, вирусы Зика, Чикунгунья, денге и ряда других, вызванные соответствующими возбудителями, заставили мировое трансфузиологическое сообщество сфокусировать внимание на поиске эффективных способов обеспечения безопасности компонентов донорской крови. В этой статье мы расскажем о том, с чем сталкиваются центры Службы крови во всем мире, как они решают вопрос с безопасностью трансфузиологических процедур и какие решения для этого используют.
Бактериальная безопасность
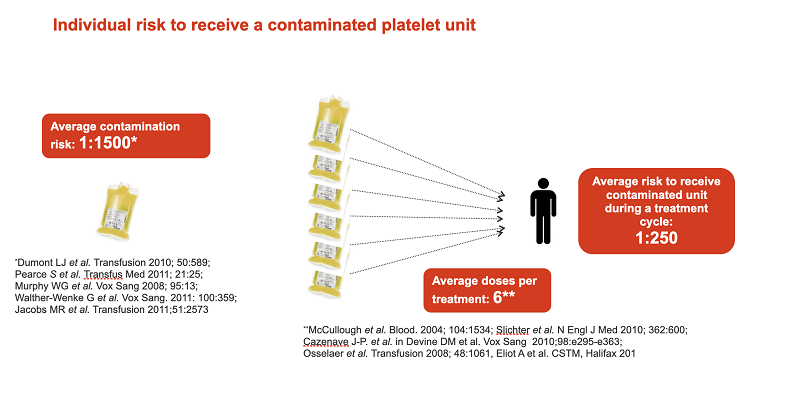
Какова вероятность, что пациенту попадется контаминированный контейнер донорских тромбоцитов? Согласно опубликованной статистике, в среднем вероятность получить зараженный патогенами компонент крови составляет 1:1500. То есть, во всем мире 1 из 1500 пациентов заражается различными патогенами через переливание крови. Риск увеличивается, когда переливание компонентов донорской крови является частью программы лечения. В среднем в процессе терапии пациент получает 6 доз компонентов донорской крови. В этом случае вероятность получить зараженный патогенами компонент крови существенно повышается и составляет примерно 1:250.
Ключевая проблема организации бактериальной безопасности при переливании крови в медицинских учреждениях заключается в том, что связь посттрансфузионного сепсиса и бактериальных инфекций с донорскими тромбоцитами мало изучена ввиду недостаточного наблюдения за реакциями пациентов после процедуры. Вместе с тем, активное изучение проблемы в профильном научном учреждении показало, что пациенты, получающие зараженные донорские тромбоциты, имели септические трансфузионные реакции.
Риск бактериальной контаминации донорской крови, особенно тромбоцитного концентрата, достаточно высок (от 1:2000). Соответственно, высока и вероятность посттрансфузионного бактериального сепсиса, который может привести к летальному исходу. Одна из наиболее чувствительных к бактериальным патогенам группа — онкогематологические пациенты, получающие в составе терапии концентраты тромбоцитов. Трансфузия бактериально контаминированных тромбоцитов в этом случае часто приводит к высокому уровню инфекционных осложнений, увеличению продолжительности лечения и ухудшению его исхода.
Тестировать или инактивировать. Экономическая целесообразность
Глобализация и глобальное потепление — факторы, которые стали драйвером быстрого распространения возбудителей различных болезней по всему миру — как вирусных, так и бактериальных. В отличие от бактерий, культуру которых можно вырастить и идентифицировать в лаборатории, для идентификации вируса требуется тест на нуклеиновые кислоты (NAT), который разработан и ориентирован на выявление конкретного, уже известного вируса. Сама разработка такого теста под каждый новый, неизвестный вирус — процесс сложный, длительный по времени и дорогой. NAT-скрининг компонентов донорской крови, используемых для трансфузий, — это дополнительные расходы для лабораторий центров Службы крови.
Например, необходимость тестировать компоненты донорской крови дополнительно на наличие вируса, вызывающего лихорадку Зика, вспышка которой была зафиксирована в США и Бразилии в 2016 году, обходится Центрам крови США примерно в 100 миллионов долларов ежегодно.
Скрининговые исследования компонентов крови значительно повысили безопасность трансфузий для реципиентов, но также увеличили расходы центров переливания крови.
По результатам исследований, опубликованных в рецензируемом медицинском журнале Vox Sanguinis, успешное внедрение технологии амплификации нуклеиновых кислот (NAT) на ВИЧ, вирусы гепатитов В и С в развитых странах позволило сократить риск трансфузионного инфицирования до 1 случая на 50 000 — 1 000 000 донаций.
Вместе с тем, результаты масштабного анализа расходов на тестирование компонентов донорской крови на упомянутые вирусы в западных странах показал, что использование даже уже разработанных тестов для выявления этих идентифицированных вирусов сопряжено с большими затратами. Это делает компоненты донорской крови — протестированные и безопасные — менее доступными для пациента.
Спектр возбудителей, передающихся с компонентами донорской крови, постоянно расширяется за счет целого ряда факторов, включая эволюцию самих возбудителей.
Сегодня в фокусе внимания мирового трансфузионного сообщества — арбовирусы, группа вирусов, которая переносится членистоногими. Лихорадка Западного Нила, Вирусы Зика, Чикунгунья и денге — наиболее распространенные из них. Арбовирусы потенциально опасны для безопасности компонентов крови с точки зрения бессимптомной фазы вирусемии у человека. Большинство видов арбовирусов не представляют угрозы для Службы крови, так как для них человек — тупиковый хозяин, не развивающий достаточную вирусемию для инфицирования. Лихорадка Западного Нила, Вирусы Зика, Чикунгунья и денге — исключение. Они и еще 130 других видов могут вызывать болезни у человека, вспышки которых происходят в городской среде. Ввиду этого, все чаще в научном сообществе озвучиваются аргументы в пользу внедрения универсальной технологии инактивации патогенов наряду с разработкой специфических NAT-тестов.
Скрининговое обследование доноров и NAT-тесты — классический реактивный подход к трансфузионной медицине. То есть, потенциальная опасность идентифицируется, медицина реагирует, а далее — разрабатываются методы борьбы с этой потенциальной опасностью. Как уже отметили, такой подход затратный по времени и финансам, что не позволяет реагировать на устранение опасности быстро. Ситуация усложняется постоянным появлением новых вирусов, которые могут нести потенциальную угрозу гемотрансмиссивных инфекций.
По данным экспертов глобального проекта “Виром” (Virome), которые занимаются изучением вирусов, существует примерно 1,3 миллиона неидентифицированных вирусов. По их оценкам, около 500 тысяч из них, вероятно, являются зооносными, то есть могут передаваться от животных людям. Только за последние 5 лет ученые проекта обнаружили 820 новых вирусов, и крайне трудно сказать, какие из этих вирусов уже живут в организмах людей и животных, как и предсказать, какие заболевания в будущем они могут вызвать. Поскольку вирусы постоянно эволюционируют и видоизменяются, разработка специфических NAT под каждый новый вид для скрининга доноров (и связанные с этим временные и финансовые затраты) может поставить под угрозу стабильность снабжения компонентами донорской крови центров Служб крови по всему миру.
Технология инактивации патогенов в компонентах донорской крови — это проактивный подход к обеспечению безопасности трансфузионных процедур. Именно поэтому она является эффективной альтернативой NAT-скринигу. Инактивация патогенов ориентирована на устранение как известных, так и неизвестных вирусов и бактерий, и получение на выходе очищенных и безопасных компонентов донорской крови. Это в свою очередь позволяет исключить риск заражения реципиента, избежать осложнений после трансфузий и, главное, сократить расходы на обеспечение безопасности компонентов донорской крови.
По оценкам клиницистов, переливание патогенинактивированных компонентов донорской крови позволило сократить количество посттрансфузионных реакций на 30-90 процентов. Согласно данным, опубликованным в статье Американской ассоциации банков крови, переливание патогенинактивированных тромбоцитов контрольной группе пациентов из 100 000 человек по всему миру прошло без каких-либо серьезных посттрансфузионных реакций.
Доказательством эффективности патогенинактивации в сравнении с NAT-скринингом доноров может служить опыт Центра крови Валенсии (Испания). Центр использует плазму, патогенредуцированную метиленовым синим, а также карантинизированную плазму. Центр переливания крови Валенсии карантинизирует плазму двумя путями: пассивным (когда донор сам приходит на очередную донацию) и активным (донора вызывают только для обследования). Для оптимизации затрат Центр оценил экономическую эффективность используемых технологий при условии продажи для фракционирования всей неивостребованной карантинизированной плазмы. Выяснили следующее:
- По сравнению с пассивной карантинизаций инактивация патогенов метиленовым синим увеличивает расходы Центра на 850,4 тысячи евро (на 7,2 евро больше в расчете на 1 пациента), а по сравнению с активной — приводит к существенной экономии в размере 5,8 миллиона евро (снижение затрат на 1 пациента в размере 50,4 евро) в течение 5 лет.
- Инактивация патогенов метиленовым синим эффективней карантинизированной плазмы по результатам всех анализов.
Технологии инактивации патогенов
Вопреки широкому применению NAT в обследовании доноров, в развитых странах продолжают регистрировать случаи гемотрансмиссивных заражений ВИЧ, гепатитами В и С. По прогнозам исследователей, примерно каждые 5 лет будет появляться как минимум один новый патоген, передающийся через переливание компонентов крови. Ввиду этого, особое внимание центров переливания крови должно быть сфокусировано на донорах-путешественниках, возвращающихся с эпидемических регионов.
Главный недостаток реактивного подхода к обеспечению безопасности трансфузий в том, что при отсутствии NAT для тестирования донора на специфический патоген, единственный возможный вариант действий — отвод донора. Такая стратегия ставит под угрозу регулярное снабжение клиник компонентами донорской крови. Подобного сценария позволяет избежать технология инактивации патогенов, универсальность и эффективность которой позволяет заменить применяемые сейчас реактивные меры по обеспечению безопасности компонентов донорской крови.
Для инактивации патогенов применяют 4 одобренных на сегодняшний день метода для плазмы крови:
- метиленовый синий + видимый свет — используют для подготовки отдельных доз для трансфузии
- растворитель-детергент — применяется в основном для промышленного фракционирования
- амотосален в сочетании с ультрафиолетовым излучением с длиной волны А — для инактивации аферезных доз до 650 мл
- рибофлавин в сочетании с ультрафиолетовым светом
Указанные выше методы не предназначены для инактивации патогенов в клеточных компонентах крови, поскольку они сильно повреждают тромбоциты и эритроциты.
Для инактивации патогенов в концентратах клеток используют технологии, которые легли в основу двух разработок — Intercept компании Cerus и Mirasol компании Terumo BCT. Остановимся на них подробней.
Технология INTERCEPT
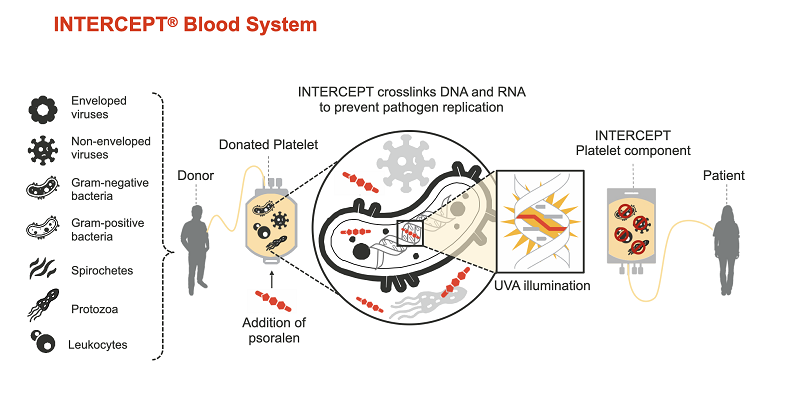
Intercept — технология инактивации патогенов в клетках крови, разработанная корпорацией Cerus (США). Она базируется на уникальной фотохимической технологии связывания нуклеиновых кислот: после забора аферезных тромбоцитов у донора, предположительно содержащих патогены (бактерии или вирусы), полученный биоматериал смешивается с веществом-инактиватором и обрабатывается ультрафиолетовым излучением. В качестве вещества-инактиватора используется синтетический псорален S-59, который проникает сквозь мембраны клеток и ядер и связывается с нуклеиновыми кислотами. Далее, под воздействием ультрафиолетового света с длиной волны А образуются поперечные связи нуклеиновых кислот и псоралена, повреждаются ДНК вирусов, бактерий и других патогенов. Действие технологии тщательно исследовали, и было отмечено высокую частоту ковалентных связей, которые эффективно блокируют репликации, транскрипции и восстановление ДНК и РНК патогенов. Несвязанные псоралены и их фотопродукты убирают с помощью адсорбционного устройства.
Читайте также: Как обеспечить безопасность донорской крови и снизить риск посттрансфузионных реакций. Обзор системы INTERCEPT
Технология Mirasol
В технологии Mirasol, разработанной компанией Terumo BCT (США), в качестве инактиватора используется витамин В2 (рибофлавин). Под воздействием ультрафиолетового света работает как фотосенсибилизатор и приводит к окислению нуклеиновых кислот, без связывания с ними или белками. В результате рибофлавин превращается в люмихром и производные фотопродукты. Технология необратимо повреждает ДНК и РНК патогенов, подавляет процесс репликации и механизмы восстановления нуклеиновых кислот. Однако, по результатам испытаний, генерируемые технологией АФК отрицательно влияют на молекулярную целостность лабильных факторов свертывания крови.
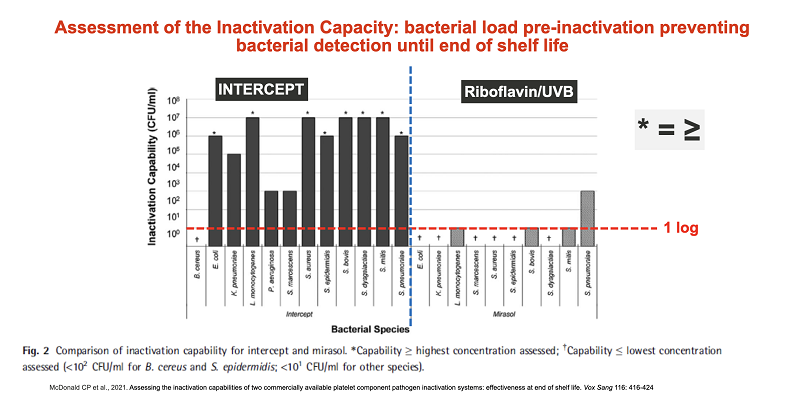
В феврале 2021 года в издании Vox Sanguinis были опубликованы результаты сравнительного анализа эффективности технологий Intercept и Mirasol для инактивации патогенов в клетках донорской крови. Исследователи оценивали технологии на основании отсутствия жизнеспособных бактерий в патогенинактивированных концентратах тромбоцитов в конце срока их хранения. Результаты сравнительного анализа показали, что технология Intercept эффективней справляется с задачей инактивации патогенов и срок хранения патогенинактивированного тромбоконцентрата с помощью технологии Intercept может быть увеличен с 5 до 7 дней.
Желаете узнать больше о системе для инактивации патогенов Интерсепт? Заполните, пожалуйста, форму, и получите запись вебинара доктора Маркуса Пикарда-Моро, директора по вопросам науки в странах Европы, Ближнего Востока и Африки корпорации Cerus.