В даній статті детально розглянута процедура практичного проведення серологічного Т-клітинного крос-матчу з використанням методики посиленої цитотоксичності проти людського глобуліну (AHG-CDC) та В-клітинного крос-матчу. Про методи тканинного типування та протоколи підготовки можна дізнатися в попередній статті.
Проведення серологічного Т-клітинного крос-матчу з використанням методики посиленої цитотоксичності проти людського глобуліну (AHG-CDC)

Реагенти та обладнання:
- Шприци Hamilton на 1 мкл та 5 мкл
- Камера Горяєва
- Пробірки на 1.5 мл
- Фазово-контрастний інвертований мікроскоп із об’єктивом 40x
- Центрифуга
- Терасакі 72-лункові планшети
- Контрольні сироватки (Anti-lymphocyte serum, Anti-T cell serum, Normal human serum)
- 0,4% Трипановий синій
- Eosin Y, формальдегід, Phenol red, 1N potassium hydroxide (KOH) або sodium hydroxide (NaOH)
- Phosphate Buffered Saline (PBS) без Са та Мg
- McCoy’s Media або RPMI з 0.5% heat inactivated FСS (HIFCS)
- Кролячий комплімент Клас 1 (Кат # CABC-1D)
- Goat IGG Anti-Human Kappa (Кат # AHG1)
- Мінеральне масло
Покрокова процедура:
- Приготувати планшет для скринінгу сироватки, додавши по 1 мкл кожної досліджуваної сироватки та сироватки негативного та позитивного контролю у відповідні лунки 72-лункового планшету Терасакі та покрити сироватки 5 мкл мінеральної олії для запобігання випаровуванню.
- Довести концентрацію Т-клітин (отриманних з Dynabeads HLA CLASS I) до 2-3 мільйонів/мл за допомогою поживного середовища та порахувати на життєздатність (має бути 90% та вище). Життєздатність розраховується як кількість життєздатних клітин поділене на загальне число клітин в камері Горяєва. Клітини, пофарбовані 0,4% трипановим синім (1:1 з клітинною суспензією), вважаються нежиттєздатними.
- Додайте 1 мкл добре перемішаної суспензії клітин до кожної досліджуваної лунки сироватки та контролів. Капайте зверху на олію, обережно, щоб не торкнутися сироватки кінчиком голки для уникнення перехресного забруднення.
- Перевірте наявність контакту сироватки з клітинами у кожній лунці та ретельно перемішайте клітини та сироватки змішувачем або голкою шприца, якщо компоненти розділені. Промивайте голку між сироватками. Інкубуйте при кімнатній температурі (20-25º C) протягом 30 хвилин.
- Розморозити AHG (зберігається в нерозведеному вигляді) та кролячий комплімент (C’). Приготуйте робоче розведення AHG з RPMI 1640. Відновити комплімент додавши 1 мл стерильної води при температурі 2-5° C. Зберігати при температурі 2–5 °C до використання. Невикористаний комплімент повинен бути розподілений на аліквоти і зберігатися при -20 °C або нижче.
- Після інкубації додайте 5 мкл середовища (RPMI 1640) у кожну лунку. Переконайтеся, що промивна рідина потрапляє під масло, і добре перемішати.
- Помістіть планшети в центрифугу; прискорити центрифугу до 1000 об/хв; потримайте 10 секунд і вимкнути.
- Обережно злити супернатант, повторити промивку 2 рази.
- Додайте 5 мкл мінеральної олії в кожну лунку.
- Додайте 5 мкл суміші AHG/C’ у кожну тестову лунку.
- Інкубувати протягом 60 хвилин при 20-25ºC.
- Фарбування:
0,4% Трипановий синій
- Видаліть надлишок комплементу піпетуванням або струшуванням планшету швидким рухом зап’ястя, обережно, щоб не витрусити клітини.
- Додайте до кожної лунки 0,4% розчину трипанового синього, обережно, щоб не порушити клітини. Залишити на 5-10 хв, потім видалити надлишок барвника, як на попередньому кроці.
5% Еозин-Y (натрієва основа) та фіксація формальдегідом
- Приготування 5% водного розчину: перед кожним використанням фільтрувати; зберігати при кімнатній температурі. Формальдегід (37% формалін): додати 2 мл 5% розчину фенол-червоного кольору до 500 мл формальдегіду; додати 10N KOH для доведення рН до 7,2-7,4; зберігати при кімнатній температурі та фільтрувати перед кожним використанням.
- Зупиніть і зафіксуйте реакцію, додавши 5 мкл 5% еозину в кожну лунку, а потім через 2 хвилини додайте 5 мкл розчину формальдегіду. Дайте клітинам осісти протягом 10 хвилин.
Читайте також: Частина 1. Методи тканинного типування. Протоколи підготовки.
Проведення серологічного В-клітинного крос-матчу
Реагенти та обладнання:
- Шприци Hamilton на 1 мкл та 5 мкл
- Камера Горяєва
- Пробірки на 1.5 мл
- Фазово-контрастний інвертований мікроскоп із об’єктивом 40x
- Центрифуга
- Терасакі 72-лункові планшети
- Контрольні сироватки (Anti-lymphocyte serum, Normal human serum)
- 0,4% Трипановий синій
- Eosin Y, формальдегід, Phenol red, 1N potassium hydroxide (KOH) або sodium hydroxide (NaOH)
- Phosphate Buffered Saline (PBS) без Са та Мg
- McCoy’s Media або RPMI з 0.5% heat inactivated FСS (HIFCS)
- Кролячий комплімент Клас 2 (Кат # CDR-1D)
- Мінеральне масло
Покрокова процедура:
- Приготувати планшет для скринінгу сироватки, додавши по 1 мкл кожної досліджуваної сироватки та сироватки негативного та позитивного контролю у відповідні лунки 72-лункового планшету Терасакі та покрити сироватки 5 мкл мінеральної олії для запобігання випаровуванню.
- Довести концентрацію В-клітин (отриманих з Dynabeads HLA CLASS IІ) до 3 мільйонів / мл за допомогою поживного середовища та порахувати на життєздатність (має бути 90% та вище). Життєздатність розраховується як кількість життєздатних клітин поділене на загальне число клітин в камері Горяєва. Клітини, пофарбовані 0,4% трипановим синім (1:1 з клітинною суспензією), вважаються нежиттєздатними.
- Додайте 1 мкл добре перемішаної суспензії клітин до кожної досліджуваної лунки сироватки та контролів. Капайте зверху на олію, обережно, щоб не торкнутися сироватки кінчиком голки для уникнення перехресного забруднення.
- Перевірте наявність контакту сироватки з клітинами у кожній лунці та ретельно перемішайте клітини та сироватки змішувачем або голкою шприца, якщо компоненти розділені. Промивайте голку між сироватками. Інкубуйте при кімнатній температурі (20-25º C) протягом 30 хвилин.
- Після інкубації додайте 5 мкл C ’у кожну тестову лунку.
- Інкубувати протягом 60 хвилин при 20-25ºC.
- Фарбування:
0,4% Трипановий синій
- Видаліть надлишок комплементу піпетуванням або струшуванням планшету швидким рухом зап’ястя, обережно, щоб не витрусити клітини.
- Додайте до кожної лунки 0,4% розчину трипанового синього, обережно, щоб не порушити клітини. Залишити на 5-10 хв, потім видалити надлишок барвника, як на попередньому кроці.
5% Еозин-Y (натрієва основа) та фіксація формальдегідом
- Приготування 5% водного розчину: перед кожним використанням фільтрувати; зберігати при кімнатній температурі. Формальдегід (37% формалін): Додати 2 мл 5% розчину фенол-червоного кольору до 500 мл формальдегіду; додати 10N KOH для доведення рН до 7,2-7,4; зберігати при кімнатній температурі та фільтрувати перед кожним використанням.
Зупиніть і зафіксуйте реакцію, додавши 5 мкл 5% еозину в кожну лунку, а потім через 2 хвилини додайте 5 мкл розчину формальдегіду. Дайте клітинам осісти протягом 10 хвилин.
Т або В – лімфоцитарний крос-матч (імуномагнітні частинки)

Реагенти та обладнання:
- Шприци Hamilton на 1 мкл та 5 мкл
- Пробірки на 1.5 мл
- Флуорисцентний інвертований мікроскоп
- Центрифуга
- Терасакі 72-лункові планшети
- Контрольні сироватки (Anti-lymphocyte serum, Anti-B cell serum, Anti-Т cell serum, Normal human serum)
- Phosphate Buffered Saline (PBS) без Са та Мg
- McCoy’s Media або RPMI з 0.5% heat inactivated FСS (HIFCS)
- Кролячий комплімент Клас 1 (Кат # CABC-1D)
- Кролячий комплімент Клас 2 (Кат # CDR-1D)
- Etidium Bromid та Сarboxyfluoroscein diacetate (CFDA).
Гасіння фону – чорнило, гемоглобін
АБО готовий реагент FluoroQuench™ Acridine Orange/Ethidium Bromide
- Мінеральне масло
Покрокова процедура:
CFDA метод
- Додати 5 мкл мінеральної олії в кожну лунку планшету Терасакі. Помістити 1 мкл кожної досліджуваної сироватки, а також сироваток негативного та позитивних контролів.
- Зняти кришку та помістити пробірку з суспензією клітин отриманих з FluoroBeads®-Т або FluoroBeads®-В в магнітний сепаратор на 1 хвилину. Злити супернатант та ресуспендувати клітини (бідси) у PBS. Повторити двічі.
- Додати 0,5 мл CFDA (робочий розчин, рН 5,5) і перемішати.
- Інкубувати пробірку горизонтально в темряві протягом 10 хвилин при 20 ° C до 25 °C.
- Повторити крок 2 вище. Ресуспендувати клітини в 0,5 мл середовища з 5% HIFCS.
- Додати 1 мкл суспензії клітин у порожню лунку планшету Терасакі та перевірити кількість клітин за допомогою флуоресцентного мікроскопа. Довести концентрацію до 2 х 106 / мл (2000 клітин на лунку).
- Перемішати суспензію клітин перевертаючи пробірку (не перемішувати піпетуванням з шприцом). Додати 1 мкл мічених CFDA клітин (бідсів) у кожну лунку планшету Терасакі. Переконайтесь, що клітини та сироватки змішались.
- Інкубувати у темряві протягом 30 хвилин при 20 ° C до 25 ° C.
- Додати 5 мкл кролячого АВС або DR комплементу у кожну лунку.
- Інкубувати планшет у темряві протягом 1 години при 20 ° C до 25 ° C.
- У кожну лунку додати 5 мкл одного з наступних інгредієнтів:
- ЕB/ робочий розчин гемоглобіну або
- EB / 1% робочий розчин чорнила
12. Планшети можна прочитати відразу, або їх можна зберегти у темряві при температурі від 20 ° до 25 ° C до 2 днів.
FQAE метод
- Додати 5 мкл мінеральної олії в кожну лунку планшету Терасакі. Помістити 1 мкл кожної досліджуваної сироватки, а також сироваток негативного та позитивних контролів.

- Додайте 1 мкл клітин (бідсів) у порожню лунку планшету Терасакі та додати 5 мкл реагенту FQAE.
- Перевірити кількість клітин за допомогою флуоресцентного мікроскопа. Довести концентрацію до 2 х 106 / мл (2000 клітин на лунку).

- Перемішати суспензію клітин перевертаючи пробірку (не перемішувати піпетуванням з шприцом). Додайте 1 мкл клітин (бідсів) у кожну лунку планшету Терасакі. Переконайтесь, що клітини та сироватки змішались.
- Інкубувати у темряві протягом 30 хвилин при 20 ° C до 25 ° C.
- Додати 5 мкл кролячого АВС або DR комплементу у кожну лунку.
- Інкубувати планшет у темряві протягом 1 години при 20 ° C до 25 ° C.
- У кожну лунку додайте 5 мкл FQAE.
- Планшети можна прочитати відразу, або їх можна зберегти у темряві при температурі від 20 ° до 25 ° C до 2 днів.
Зчитування та інтерпретація результатів комплімент-залежного мікроцитотоксичного крос-матчу/CDC Crossmatch (ASHI Manual)
- Робочий аркуш кожного планшету має включати ім’я пацієнта або донора, дату, ініціали операціоніста, що проводить випробування, тип кросс-матчу, температуру, яка використовується для тесту та відсоток життєздатності клітин.
- Переконайтеся, що робочий аркуш планшету відповідає кожному тестовому планшету безпосередньо перед його аналізом у полі зору мікроскопа.
- Зчитування планшету відбувається по-серпантину. (Прочитати вздовж ряду 1 [лунки A-F], потім назад вздовж ряду 2 [F-A] тощо)
- Запишіть результати на правильному робочому бланку відповідно до наступної шкали та примітки:
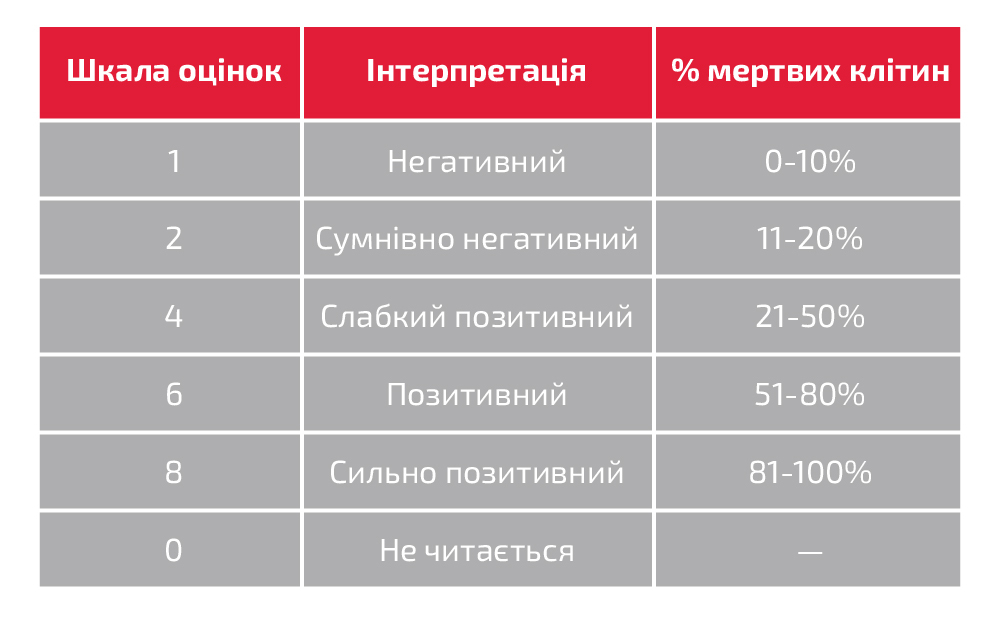
Примітка: Зазвичай оцінку негативного контролю реєструють так, як вона інтерпретується в тесті, а всі інші оцінки записують із вирахуванням фону (тобто значення негативного контролю).
- Якщо значення дорівнює або менше негативного контролю, то операціоніст записує показання із вирахуванням фону або зазначає на аркуші відповідним чином, що фон вище за звичайний.
- Усі фактичні оцінки мають бути записані, якщо бали тестових реакції перевищують показники негативного контролю.
5. Інтерпретуйте результати наступним чином (див. ASHI Manual, “Interpretation of Crossmatch Results”):
- Будь-яку позитивну реакцію, яка на 11% перевищує значення негативного контролю, слід інтерпретувати як ПОЗИТИВНИЙ КРОС-МАТЧ.
- Негативну реакцію, еквівалентну або меншу ніж 11% від негативного контролю, слід інтерпретувати як НЕГАТИВНИЙ КРОС-МАТЧ.
- Якщо контролі не реагують належним чином, повідомте про це керівника лабораторії:
- Бал негативного контролю повинен бути «2» або менше (життєздатність клітин більше 80%).
- Контроль ALS (анти-лімфоцитарний) повинен бути позитивним для Т і В-клітин з оцінкою «4» або більше.
- Контроль ABS (анти-В-лімфоциторний) повинен бути позитивним для В-клітин з оцінкою «4» або більше, а для Т-клітин – негативним.
Література
- Amy B Hahn; Geoffrey A Land; Rosemarie M Strothman; American Society for Histocompatibility and Immunogenetics. ASHI laboratory manual. American Society for Histocompatibility and Immunogenetics, ©2000, 4rth ed.
- Fuller TC, Fuller AA, Golden M, Rodey G. HLA alloantibodies and the mechanism of the antiglobulin-augmented lymphocytotoxicity procedure. Hum Immunol 56: 94-105, 1997.
- One Lambda, Inc. Product Insert for Dynabeads™ HLA CLASS I and CLASS II, MAN0009978.
- One Lambda, Inc. Product Insert for FluoroBeads®B, TDX-OLI-DMR-PS-0852, Rev 02.
- One Lambda, Inc. Product Insert for FLUOROBEADS-T AND FLUOROBEADS-T DEVELOPER, TDX-OLI-DMR-PS-2907, Rev 02.
- One Lambda, Inc. Product Insert for Goat IGG Anti-Human Kappa (Free and Bound Light Chains), TDX-OLI-DMR-PS-2448, Rev 03
