В данной статье подробно рассмотрена процедура практического проведения серологического Т-клеточного кросс-матча с использованием методики усиленной цитотоксичности против человеческого глобулина (AHG-CDC) и В-клеточного кросс-матча. О методах тканевого типирования и протоколах подготовки можно узнать в предыдущей статье.
Проведение серологического Т-клеточного кросс-матча с использованием методики усиленной цитотоксичности против человеческого глобулина (AHG-CDC)

Реагенты и оборудование:
- Шприцы Hamilton на 1 мкл и 5 мкл
- Камера Горяева
- Пробирки на 1.5 мл
- Фазово-контрастный инвертированный микроскоп с объективом 40x
- Центрифуга
- Терасаки 72-луночные планшеты
- Контрольные сыворотки (Anti-lymphocyte serum, Anti-T cell serum, Normal human serum)
- 0,4% Трипановый синий
- Eosin Y, формальдегид, Phenol red, 1N potassium hydroxide (KOH) или sodium hydroxide (NaOH)
- Phosphate Buffered Saline (PBS) без Са и Мg
- McCoy’s Media или RPMI с 0.5% heat inactivated FСS (HIFCS)
- Кроличий комплимент Класс 1 (Кат # CABC-1D)
- Goat IGG Anti-Human Kappa (Кат # AHG1)
- Минеральное масло
Пошаговая процедура:
- Приготовить планшет для скрининга сыворотки, добавив по 1 мкл каждой изучаемой сыворотки и сыворотки отрицательного и положительного контроля в соответствующие лунки 72-луночного планшета Терасаки и покрыть сыворотки 5 мкл минерального масла для предотвращения испарения.
- Довести концентрацию Т-клеток (полученных из Dynabeads HLA CLASS I) до 2-3 миллионов/мл с помощью питательной среды и сосчитать на жизнеспособность (должно быть 90% и выше). Жизнеспособность рассчитывается как количество жизнеспособных клеток, разделенное на общее число клеток в камере Горяева. Клетки, окрашенные 0,4% трипановым синим (1:1 с клеточной суспензией), считаются нежизнеспособными.
- Добавьте 1 мкл хорошо перемешанной суспензии клеток в каждую исследуемую лунку сыворотки и контролей. Капайте сверху на масло, осторожно, чтобы не коснуться сыворотки кончиком иглы во избежание перекрестного загрязнения.
- Проверьте контакт сыворотки с клетками в каждой лунке и тщательно перемешайте клетки и сыворотки смесителем или иглой шприца, если компоненты разделены. Промывайте иглу между сыворотками. Инкубируйте при комнатной температуре (20-25º C) в течение 30 минут.
- Разморозить AHG (хранится в неразбавленном виде) и кроличий комплимент (C’). Приготовьте рабочее разведение AHG из RPMI 1640. Восстановить комплимент добавив 1 мл стерильной воды при температуре 2-5 °C. Хранить при температуре 2-5 °C до использования. Неиспользованный комплимент должен быть распределен на аликвоты и храниться при –20°C или ниже.
- После инкубации добавьте 5 мкл среды (RPMI 1640) в каждую лунку. Убедитесь, что промывная жидкость попадает под масло и хорошо перемешайте.
- Поместите планшеты в центрифугу; ускорить центрифугу до 1000 об/мин; удерживайте 10 секунд и выключите.
- Осторожно слить супернатант, повторить промывку 2 раза.
- Добавьте 5 мкл минерального масла в каждую лунку.
- Добавьте 5 мкл смеси AHG/C’ в каждую тестовую лунку.
- Инкубировать в течение 60 минут при 20-25C.
- Покраска:
0,4% Трипановый синий
- Удалите избыток комплемента пипетированием или встряхиванием планшета быстрым движением запястья, осторожно, чтобы не вытряхнуть клетки.
- Добавьте к каждой лунке 0,4% раствора трипанового синего, осторожно, чтобы не нарушить клетки. Оставить на 5-10 мин, затем удалить избыток красителя, как на предыдущем шаге.
5% Эозин-Y (натриевая основа) и фиксация формальдегидом
- Приготовление 5% водного раствора: перед каждым использованием отфильтровывать; хранить при комнатной температуре. Формальдегид (37% формалин): добавить 2 мл 5% раствора фенол-красного цвета до 500 мл формальдегида; добавить 10N KOH для доведения рН до 7,2-7,4; хранить при комнатной температуре и отфильтровывать перед каждым использованием.
- Остановите и зафиксируйте реакцию, добавив 5 мкл 5% эозина в каждую лунку, а затем через 2 минуты добавьте 5 мкл раствора формальдегида. Дайте клеткам осесть в течение 10 минут.
Читайте также: Часть 1. Методы тканевого типирования. Протоколы подготовки.
Проведение серологического В-клеточного кросс-матча
Реагенты и оборудование:
- Шприцы Hamilton на 1 мкл и 5 мкл
- Камера Горяева
- Пробирки на 1.5 мл
- Фазово-контрастный инвертированный микроскоп с объективом 40x
- Центрифуга
- Терасаки 72-луночные планшеты
- Контрольные сыворотки (Anti-lymphocyte serum, Normal human serum)
- 0,4% Трипановый синий
- Eosin Y, формальдегид, Phenol red, 1N potassium hydroxide (KOH) или sodium hydroxide (NaOH)
- Phosphate Buffered Saline (PBS) без Са и Мg
- McCoy’s Media или RPMI с 0.5% heat inactivated FСS (HIFCS)
- Кроличий комплимент Класс 2 (Кат # CDR-1D)
- Минеральное масло
Пошаговая процедура:
- Приготовить планшет для скрининга сыворотки, добавив по 1 мкл каждой изучаемой сыворотки и сыворотки отрицательного и положительного контроля в соответствующие лунки 72-луночного планшета Терасаки и покрыть сыворотки 5 мкл минерального масла для предотвращения испарения.
- Довести концентрацию В-клеток (полученных из Dynabeads HLA CLASS II) до 3 миллионов/мл с помощью питательной среды и сосчитать на жизнеспособность (должно быть 90% и выше). Жизнеспособность рассчитывается как количество жизнеспособных клеток, разделенное на общее число клеток в камере Горяева. Клетки, окрашенные 0,4% трипановым синим (1:1 с клеточной суспензией), считаются нежизнеспособными.
- Добавьте 1 мкл хорошо перемешанной суспензии клеток в каждую исследуемую лунку сыворотки и контролей. Капайте сверху на масло, осторожно, чтобы не коснуться сыворотки кончиком иглы во избежание перекрестного загрязнения.
- Проверьте контакт сыворотки с клетками в каждой лунке и тщательно перемешайте клетки и сыворотки смесителем или иглой шприца, если компоненты разделены. Промывайте иглу между сыворотками. Инкубируйте при комнатной температуре (20-25ºC) в течение 30 минут.
- После инкубации добавьте 5 мкл C’ в каждую тестовую лунку.
- Инкубировать в течение 60 минут при 20-25C.
- Покраска:
0,4% Трипановый синий
- Удалите избыток комплимента пипетированием или встряхиванием планшета быстрым движением запястья, осторожно, чтобы не вытряхнуть клетки.
- Добавьте к каждой лунке 0,4% раствора трипанового синего, осторожно, чтобы не нарушить клетки. Оставить на 5-10 мин, затем удалить избыток красителя, как на предыдущем шаге.
5% Эозин-Y (натриевая основа) и фиксация формальдегидом
- Приготовление 5% водного раствора: перед каждым использованием отфильтровывать; хранить при комнатной температуре. Формальдегид (37% формалин): добавить 2 мл 5% раствора фенол-красного цвета до 500 мл формальдегида; добавить 10N KOH для доведения рН до 7,2-7,4; хранить при комнатной температуре и отфильтровывать перед каждым использованием.
- Остановите и зафиксируйте реакцию, добавив 5 мкл 5% эозина в каждую лунку, затем через 2 минуты добавьте 5 мкл раствора формальдегида. Дайте клеткам осесть в течение 10 минут.
Т или В – лимфоцитарный кросс-матч (иммуномагнитные частицы)

Т или В – лимфоцитарный кросс-матч
Реагенты и оборудование:
- Шприцы Hamilton на 1 мкл и 5 мкл
- Пробирки на 1.5 мл
- Флуоресцентный инвертированный микроскоп
- Центрифуга
- Терасаки 72-луночные планшеты
- Контрольные сыворотки (Anti-lymphocyte serum, Anti-B cell serum, Anti-T cell serum, Normal human serum)
- Phosphate Buffered Saline (PBS) без Са и Мg
- McCoy’s Media или RPMI с 0.5% heat inactivated FСS (HIFCS)
- Кроличий комплимент Класс 1 (Кат # CABC-1D)
- Кроличийкомплимент Класс 2 (Кат # CDR-1D)
- Etidium Bromid и Сarboxyfluoroscein diacetate (CFDA).
Тушение фона – чернила, гемоглобин
ИЛИ готовый реагент FluoroQuench™ Acridine Orange/Ethidium Bromide
- Минеральное масло
Пошаговая процедура:
CFDA метод
- Добавить 5 мкл минерального масла в каждую лунку планшета Терасаки. Поместить 1 мкл каждой изучаемой сыворотки, а также сывороток отрицательного и положительных контролей.
- Снять крышку и поместить пробирку с суспензией клеток, полученных из FluoroBeads®-Т или FluoroBeads®-В в магнитный сепаратор на 1 минуту. Слить супернатант и ресуспендировать клетки (бидсы) в PBS. Повторить дважды.
- Добавить 0,5 мл CFDA (рабочий раствор, рН 5,5) и перемешать.
- Инкубировать пробирку горизонтально в темноте в течение 10 минут при 20°C до 25°C.
- Повторите шаг 2 выше. Ресуспендировали клетки в 0,5 мл среды с 5% HIFCS.
- Добавить 1 мкл суспензии клеток в пустую лунку планшета Терасаки и проверить количество клеток с помощью флуоресцентного микроскопа. Довести концентрацию до 2 х 106/мл (2000 клеток в лунку).
- Перемешать суспензию клеток, переворачивая пробирку (не перемешивать пипетированием со шприцем). Добавить 1 мкл меченых CFDA клеток (бидсов) в каждую лунку планшета Терасаки. Убедитесь, что клетки и сыворотки смешались.
- Инкубировать в темноте в течение 30 минут при 20°C до 25°C.
- Добавить 5 мкл кроличьего АВС или DR комплемента в каждую лунку.
- Инкубировать планшет в темноте в течение 1 часа при 20°C до 25°C.
- В каждую лунку добавить 5 мкл одного из следующих ингредиентов:
- ЕB/ рабочий раствор гемоглобина или
- EB/1% рабочий раствор чернил
12. Планшеты можно прочесть сразу, или их можно сохранить в темноте при температуре от 20° до 25°C до 2 дней.
FQAE метод
- Добавить 5 мкл минерального масла в каждую лунку планшета Терасаки. Поместить 1 мкл каждой изучаемой сыворотки, а также сывороток отрицательного и положительных контролей.

- Добавьте 1 мкл клеток (бидсов) в пустую лунку планшета Терасаки и добавить 5 мкл реагента FQAE.
- Проверьте количество клеток с помощью флуоресцентного микроскопа. Довести концентрацию до 2 х 106/мл (2000 клеток в лунку).

- Перемешать суспензию клеток, переворачивая пробирку (не перемешивать пипетированием со шприцем). Добавьте 1 мкл клеток (бидсов) в каждую лунку планшета Терасаки. Убедитесь, что клетки и сыворотки смешались.
- Инкубировать в темноте в течение 30 минут при 20°C до 25°C.
- Добавить 5 мкл кроличьего АВС или DR комплемента в каждую лунку.
- Инкубировать планшет в темноте в течение 1 часа при 20°C до 25°C.
- В каждую лунку добавьте 5 мкл FQAE.
- Планшеты можно прочесть сразу, или их можно сохранить в темноте при температуре от 20° до 25°C до 2 дней.
Считывание и интерпретация результатов комплемент-зависимого микроцитотоксического кросс-матча/CDC Crossmatch (ASHI Manual)
- Рабочий лист каждого планшета должен включать имя пациента или донора, дату, инициалы проводящего испытания операциониста, тип кросс-матча, температуру, используемую для теста и процент жизнеспособности клеток.
- Убедитесь, что рабочий лист планшета соответствует каждому тестовому планшету перед его анализом в поле зрения микроскопа.
- Считывание планшета происходит по серпантину. (Прочитать вдоль ряда 1 [лунки A-F], затем вдоль ряда 2 [F-A] и т.д.)
- Запишите результаты на правильном рабочем бланке в соответствии со следующей шкалой и примечанием:
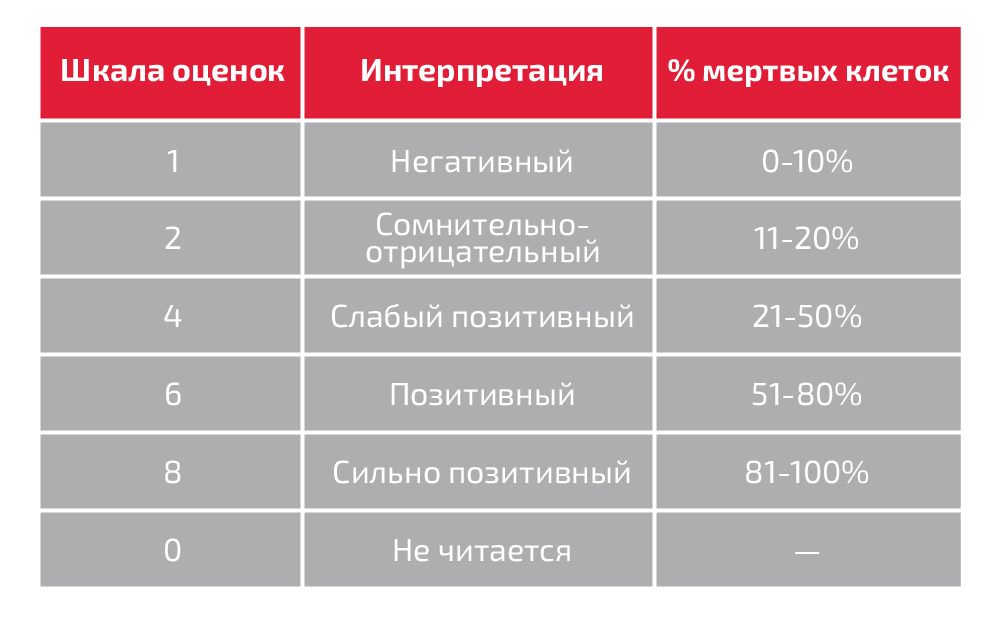
Примечание: Обычно оценку отрицательного контроля регистрируют так, как она интерпретируется в тесте, а остальные оценки записывают с вычетом фона (т.е. значение отрицательного контроля).
- Если значение равно или меньше отрицательного контроля, то операционист записывает показания с вычетом фона или указывает на листе соответствующим образом, что фон выше обычного.
- Все фактические оценки должны быть записаны, если баллы тестовых реакций превышают показатели отрицательного контроля.
5. Интерпретируйте результаты следующим образом (см. ASHI Manual, “Interpretation of Crossmatch Results”):
- Любую положительную реакцию, которая на 11% превышает значение отрицательного контроля, следует интерпретировать как ПОЗИТИВНЫЙ КРОСС-МАТЧ.
- Отрицательную реакцию, эквивалентную или менее 11% от отрицательного контроля, следует интерпретировать как отрицательный КРОСС-МАТЧ.
- Если контроли не реагируют должным образом, сообщите об этом руководителю лаборатории:
-
Балл отрицательного контроля должен быть «2» или меньше (жизнеспособность клеток больше 80%).
-
Контроль ALS (антилимфоцитарный) должен быть положительным для Т и В-клеток с оценкой «4» или более.
-
Контроль ABS (анти-В-лимфоциторный) должен быть положительным для В-клеток с оценкой «4» или более, а для Т-клеток – отрицательным.
Литература
- Amy B Hahn; Geoffrey A Land; Rosemarie M Strothman; American Society for Histocompatibility and Immunogenetics. ASHI laboratory manual. American Society for Histocompatibility and Immunogenetics, ©2000, 4rth ed.
- Fuller TC, Fuller AA, Golden M, Rodey G. HLA alloantibodies and mechanism of antiglobulin-augmented lymphocytotoxicity procedure. Hum Immunol 56: 94-105, 1997.
- One Lambda, Inc. Product Insert for Dynabeads™ HLA CLASS I и CLASS II, MAN0009978.
- One Lambda, Inc. Product Insert for FluoroBeads®B, TDX-OLI-DMR-PS-0852, Rev 02.
- One Lambda, Inc. Product Insert для FLUOROBEADS-T AND FLUOROBEADS-T DEVELOPER, TDX-OLI-DMR-PS-2907, Rev 02.
- One Lambda, Inc. Product Insert for Goat IGG Anti-Human Kappa (Free and Bound Light Chains), TDR-OLI-DMR-PS-2448, Rev 03.
