Лабораторний супровід трансплантації є невід‘ємною частиною цього процесу. Застосування адекватних сучасних та валідованих рутинних технологій забезпечує успіх трансплантації органів, триваліше повноцінне життя як графту/гемопоетичних клітин так і, власне, пацієнта, зменшує вартість та тривалість посттрансплантаційного лабораторного моніторингу та медичного супроводу пацієнта після проведення трансплантації.
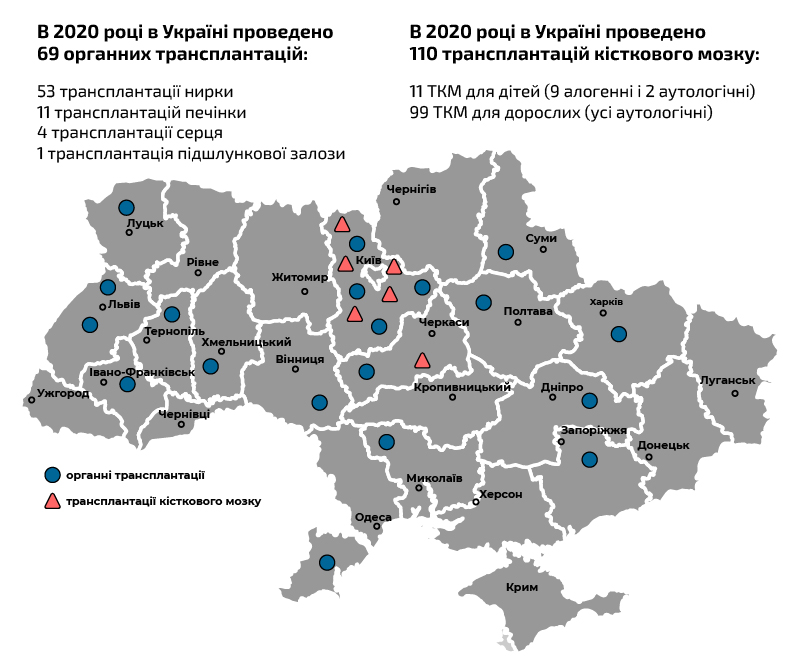
Трансплантації в Україні в 2020 році
При підборі пари донор-реципієнт, а також для створення донорських реєстрів виникає завдання проведення HLA-типування як першого етапу порядку пошуку сумісного донора у рутинній трансплантації (*порядок пошуку та протокол може відрізнятися у випадку ургентної трансплантації – див. відповідні накази МОЗ):
- Молекулярно-генетичне HLA типування донора і реципієнта методологічним підходом відповідної роздільної здатності – найкращим результатом пошуку сумісного донора є співпадіння HLA гаплотипу донора та реципієнта на рівні 10/10 середньої та високої роздільної здатності відповідно до номенклатури HLA (Міжнародна база даних IMGT/HLA Database https://www.ebi.ac.uk/ipd/imgt/hla/). Сучасна HLA-номенклатура представлена на веб-ресурсі Міжнародної асоціації імуногенетики (www.hla.alleles.org/nomenclature), де надана інформація про кількість відкритих алелів кожного HLA локусу, перелік, всіх генів HLA та їх молекулярна характеристика, зміни та доповнення до номенклатури.
- Отримання відповіді на запит про наявність гістосумісного донора у базі даних Реєстру.
- Проведення порівняння відповідних HLA-антигенів донора та реципієнта. За результатами відбирається донор з повністю сумісним або частково сумісним (у деяких випадках) з пацієнтом набором алелів.
- Надання відповіді на пошуковий запит у встановленій формі та у необхідний термін.
- У випадку співпадіння генотипів потенційного донора та реципієнта направляється запит на активацію донора, підписання інформованої згоди на донацію.
- Після проведення необхідних інформаційних та інфекційних заходів лабораторний супровід розширюється відповідними лабораторними тестуваннями, а саме іммунологічних (визначення передіснуючих HLA-зв‘язаних антитіл) та серологічних (крос-матч) методів типування.
Серологічні методи HLA-типування
Серологічні методи засновані на ідентифікації молекул МНС, експресованих на мембрані, за допомогою специфічних антитіл. На практиці серологічне типування є останнім етапом (!!!!) типування та проводиться на виділених клітинних популяціях. Оскільки основними носіями антигенів МНС є лімфоцити, суспензію Т-лімфоцитів використовують для визначення антигенів класу І, а суспензію В-лімфоцитів – для визначення антигенів класу ІІ гістосумісності. Найбільш поширеним методом типування HLA-антигенів є лімфоцитотоксичний тест «крос-матч», модифікований Полем Терасакі та останнім часом, через розвиток методологій, проводиться двома лабораторними підходами:
- класичним CDC – у плашках Терасакі з застосуванням інвертованого мікроскопу для аналізу)
- протоковою цитометрією (більш сучасний підхід) – сам тест проводиться на протоковому цитометрі та аналізується програмним забезпеченням приладу з подальшою можливістю проводити віртуальний крос-матч.
Стандартний лімфоцитотоксичний крос-матч в плашках Терасакі із застосуванням інвертованої мікроскопії для аналізу
Принцип лімфоцитотоксичного тесту (крос-матч) заснований на здатності специфічних антитіл взаємодіяти з HLA-антигенами відповідної до антитіл специфічності, утворюючи комплекс «антиген-антитіло». Зв‘язування компліменту з комплексом антиген-антитіло запускає каскад реакцій, що призводить до пошкодження клітинної мембрани і лізису клітин. У разі негативної реакції лімфоцити залишаються неушкодженими. При позитивній реакції лімфоцити руйнуються. Візуалізація позитивної реакції проводиться за допомогою суправітальних барвників (еозин, трипановий синій) або на більш сучасному рівні за допомогою флуоресцентних барвників. Визначення фенотипу HLA – проводиться за сукупністю позитивних та негативних реакцій.
Для крос-матч використовуються моноклональні антитіла або панель діагностичних сироваток з широким спектром антитіл до HLA-антигенів різних специфічностей. Діагностичні сироватки з HLA-антигенами отримуються від імунізованих донорів. Імунізація може бути викликана вагітністю (у 10-20% вагітних виробляються антитіла до батьківських HLA-антигенів HLA гаплотипу плоду), переливанням крові або трансплантацією органів. Спрямована імунізація донорів пересадкою шкіри, переливанням крові або лейкоцитарної маси призводить до появи високоактивних антитіл до HLA-антигенів.
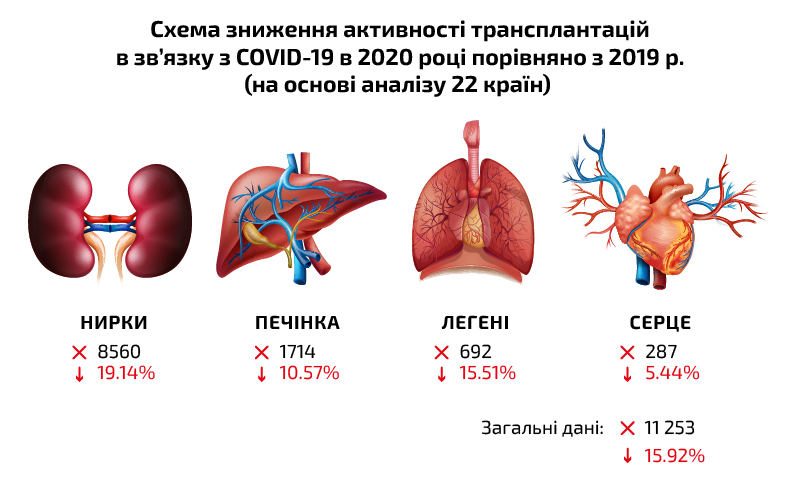
Схема зниження активності трансплантаций в зв’язку з COVID
Протоколи виділення Т та В лімфоцитів для подальшого проведення серологічного крос-матчу
А) Виділення HLA клас І та клас ІІ антиген-експресуючих клітин з цільної крові за допомогою магнітних частинок Dynabeads™ HLA CLASS I та/або CLASS II (21001D, 21002D, 21003, 21004D) на магнітному штативі
Реагенти та обладнання:
- Dynabeads ™ HLA Клас I містить 1,4 × 108 бідсів/мл – 2 мл (20 виділень)
- Dynabeads ™ HLA Клас II містить 2,8 × 108 бідсів/мл – 2 мл (20 виділень)
- PBS, pH 7.4, з цитратом натрію (додати 0.6% v/v цитрату натрію)
- PBS, pH 7.4
- Середовище RPMI*
- FBS heat-inactivated (інактивувати 60 хв при 56°C на водяній бані)
- DynaMag магніт/Easysep магніт
- Змішувач, що дозволяє нахиляти та обертати пробірки
- Пробірки для забору крові, що містять антикоагулянт (ACD, натрій гепарин)
- Пробірки 5 та 15 мл
- 5 мл піпетки
- Контейнер для зливу
- Охолоджувальний пристрій
Покрокова процедура:
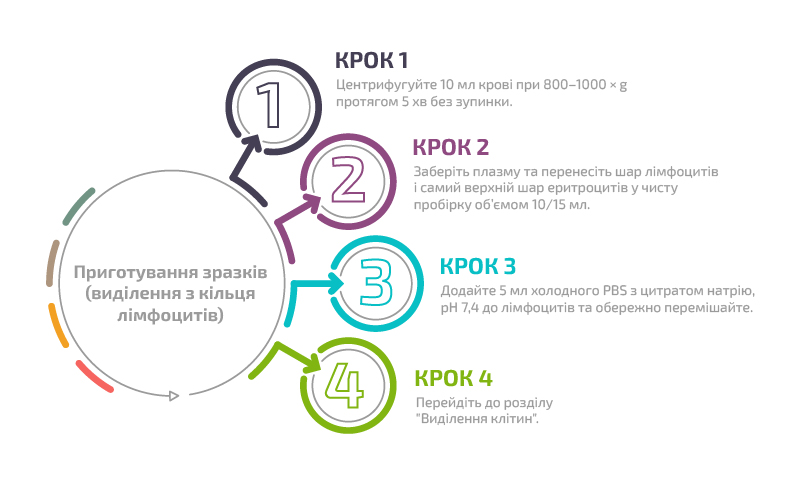
Приготування зразків (виділення з кільця лімфоцитів)
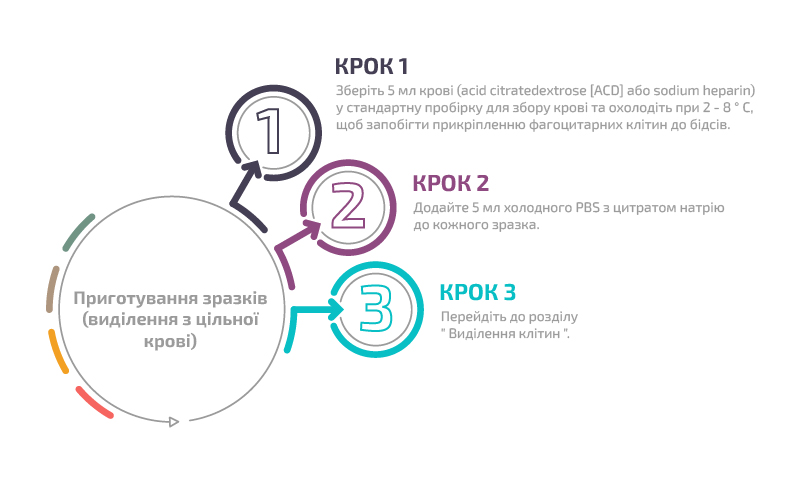
Приготування зразків (виділення з цільної крові)

Виділення клітин
Б) Виділення Т лімфоцитів за допомогою специфічного реагенту FluoroBeads®-Т
Реагенти та обладнання:
- Набір FluoroBeads®-Т
- FluoroBeads®-T Developer (10X)
- Phosphate Buffered Saline (PBS) без Са та Мg
- Магнітний сепаратор (One Lambda або аналог)
- Аспіратор/піпетки Пастера
- Пробірки на 15 та 5 мл з кришками
- Мікроцентрифугa або настільна центрифуга
- McCoy’s Media чи RPMI з 5% heat inactivated FСS (HIFCS)
Покрокова процедура:
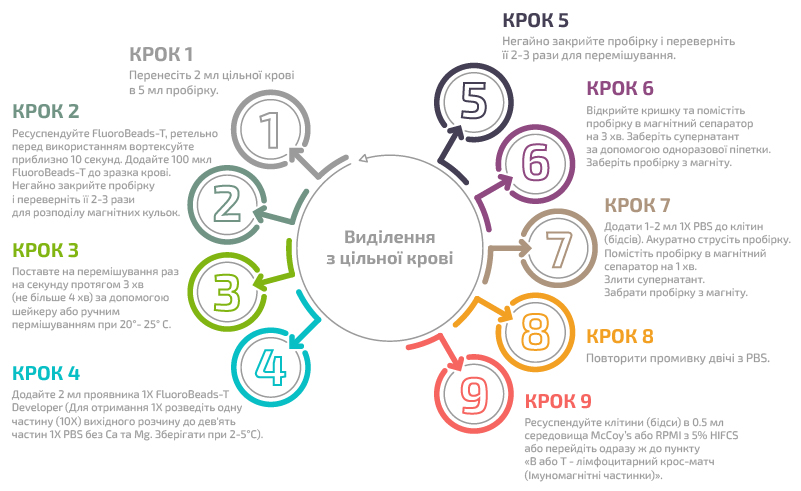
Виділення з цільної крові
В) Виділення В лімфоцитів за допомогою специфічного реагенту FluoroBeads®-B
Реагенти та обладнання:
- Набір FluoroBeads®-B
- PBS/Citrate реагент (Кат.#PC1-500)
- Магнітний сепаратор (One Lambda або аналог)
- Аспіратор/піпетки Пастера
- Пробірки на 15 мл
- Мікроцентрифугa або настільна центрифуга
- Phosphate Buffered Saline (PBS) без Са та Мg
- McCoy’s Media чи RPMI з 0.5% heat inactivated FСS (HIFCS)
Покрокова процедура:
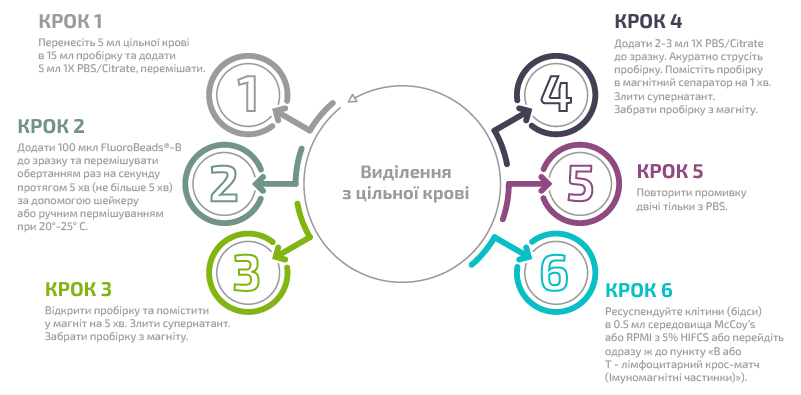
Виділення з цільної крові
Про процедуру проведення серологічного крос-матчу детально розповімо в наступній статті.