Більшість аналітиків вже знають, що підвищені температури, як і наявність кисню, руйнують стаціонарну фазу колонки зсередини. Однак, є кілька мало відомих «вбивць» капілярних колонок, такі як pH зразку, реагенти для дериватизації, вміст сірки, а також водні інжекції. Нижче розглянемо детальніше ці показники.
Хоча кількісних даних на підтвердження цих рекомендацій немає, нижченаведена інформація базується на власному досвіді та відгуках досвідчених аналітиків. Ці чотири показники ні в якому разі не є вичерпними, але ми сподіваємось, що перед наступною інжекцією зразка ви зупинитеся і подумаєте, що конкретно вводите в капілярну колонку.

Отже, почнемо!
Екстремальне значення pH зразка
Значення pH зразка/екстракту, що інжектується в капілярну колонку ГХ, може потенційно спричинити руйнування стаціонарної фази та/або деактивованого шару всередині кварцової трубки, якщо буде знаходитись поза межами діапазону рН від 5 до 9. Рівень рН поза цим діапазоном сприяє швидкому руйнуванню колонки та гіршим хроматограмам. Чим далі рН зразка/екстракту знаходиться поза «безпечними» значеннями, тим швидше виникне пошкодження.
Якщо ви підозрюєте, що ваш зразок/екстракт може мати такий рН, використайте лакмусову стрічку для перевірки.
Якщо ви виявите, що рН зразка/екстракту виходить за межі цього діапазону, то все одно можете проаналізувати зразок, але вам слід відрегулювати його так, щоб рН потрапляв у діапазон 5-9. Це можна зробити кількома різними способами, але, безумовно, найкращий спосіб — розбавити зразок/екстракт.

Для аналізу основних сполук застосовуються колонки Rtx-Volatile Amine, Rtx-5 Amine, Rtx-35 Amine, та Stabilwax-DB, де рН рекомендується в діапазоні 7-9. Для аналізу кислотних сполук для колонок Stabilwax-DA рекомендований діапазон pH 5-7.
Реагенти для дериватизації

Дериватизаційні реагенти зазвичай застосовуються у газовій хроматографії для перетворення нелетких сполук у леткі методом заміщення певних функціональних груп іншими. Дериватизація може також застосовуватися для підвищення термічної стабільності сполук та/або відгуку детектора.
Однак, перед тим, як ви розпочнете новий проект, задумайтеся ось про що.

Одні з найбільш руйнівних дериватизаційних реагентів – це реагенти для ацилювання ангідриду перфторкислоти:
- трифтороцтовий ангідрид (TFAA);
- пентафторпропіоновий ангідрид (PFPA);
- гептафтормасляний ангідрид (HFBA).
Ці реагенти формують з кислоти побічні продукти, що будуть атакувати стаціонарну фазу колонки. Силілові реагенти трифтороцтової кислоти (TFA) та диметилдихлорсилан (DMDCS) особливо руйнують стаціонарну фазу поліетиленгліколь (колонки Carbowax), але набагато менш шкідливі для полісилоксанових стаціонарних фаз. Як і багато силілових реагентів, похідні TMS реагують з активними атомами водню, тому при аналізі цих екстрактів зразків слід уникати використання колонок із стаціонарною фазою з поліетиленгліколю (Carbowax).
В той час, як більшість дериватизаційних агентів руйнують колонку, є кілька винятків, присутність яких майже не зашкодить стаціонарній фазі капілярної колонки. Серед таких виключень:
- реагенти для ацилювання N-метилбіс трифторацетамід (MBTFA);
- перфторацилімідазоли (трифторацетилімідазол (TFAI), пентафторпропанілімідазол (PFPI), гептафторбутирилимідазол (HFBI)).

Елементна сірка

Або аналітики роками знали, що ця сполука була в їхніх зразках/екстрактах, або вони були здивовані, коли врешті дізналися, що ця сполука погіршувала хроматографічний аналіз.
Багато зразків, особливо нафтопродуктів, можуть містити елементну сірку. Це не є новиною, оскільки багато джерел сірки надходить з природного газу та нафтопродуктів (Sulfur). Інші подібні зразки навколишнього середовища, що можуть містити високий рівень сірки, це морські відкладення та стічні води.
Хоча елементна сірка не зруйнує колонку відразу й безпосередньо, однак, вона може накопичуватися у фазі, а видалити її звідти дуже важко. Сірка дуже активна, і як тільки фаза колонки забруднюється нею, це може стати причиною адсорбції та/або руйнування активних сполук у наступних зразках. Це особливо актуально для пестицидів.
EPA відомо вже багато років, що зразки, забруднені сіркою, можуть спричинити проблеми з аналізом такого зразку. Три найпоширеніші методи, де вони згадують це: 8081A, 8082A і 8141A. Зразки, де підозрюють наявність елементної сірки, рекомендують обробити активованою міддю або розчином сульфіту тетрабутиламонію. Деталі щодо видалення сірки із зразків наведені в методі US EPA 3660B .

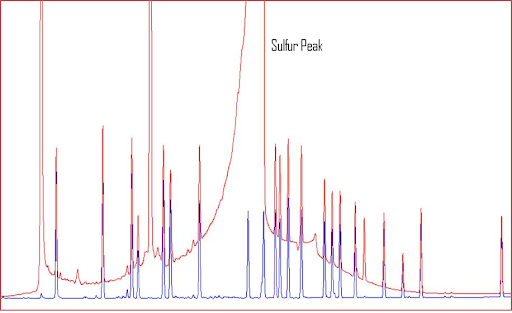
Нижче на прикладі хроматограми показаний пік сульфуру (надана Джеком Кохраном (Jack Cochran)). Червона хроматограма показує зразок перед очищенням, а блакитна – після очищення. Він також уточнив, що визначувані сполуки були хлорорганічні пестициди, а детектор – ЕЗД. Як ви бачите, цей величезний пік сірки не тільки може ускладнити кількісне визначення цільових сполук, але, як згадувалося раніше, він може зробити вашу колонку дуже сприятливою до утворення хімічних реакцій.
Звичайно, бувають ситуації, коли метою аналізу є пошук і кількісне визначення елементної сірки. Кілька методів ASTM були створені саме для кількісного визначення елементної сірки у нафтових продуктах. Ще раніше були розроблені методи для пошуку елементної сірки та інших сірковмісних сполук у гіпсокартоні. Постер EPA за посиланням має приклади кількох хроматограм, де показаний пік сірки на ЕЗД – аналіз елементної сірки у гіпсокартоні методом ГХ/ЕЗД.
Як висновок, можна додати, якщо ви маєте проблеми з хроматограмою, як-от, «хвостові» піки, втрати чи зменшення кількості цільових сполук, та не пояснювані контамінанти («горби») після аналізу нафтових продуктів, морського осаду чи промислових зливів, це може бути негативним ефектом присутності елементної сірки у вашому зразку/екстракті. Для того, щоб ваші піки були гострими, а колонка прослужила довше, витратіть трохи часу, щоб видалити цю сполуку з вашого зразка/екстракту перед аналізом.
Водні інжекції
Існує багато помилкових уявлень про водні інжекції в ГХ – і не без причини. Незважаючи на загальні правила, що електроніка та вода не повинні поєднуватися, багато аналітиків все ж проводять такі експерименти. Через велику кількість дзвінків щодо водних інжекцій компанія Restek створила лист поширених питань та відповідей. Надаємо список нижче з усіма активними посиланнями
FAQ: Чи можу я інжектувати воду в мою колонку? Це зруйнує її чи ні?
Коли справа доходить до водних інжекцій, не переймайтеся, оскільки більшість повністю зв’язаних полімерних фаз капілярних колонок не буде пошкоджено.

В той час, як існує загальне правило уникати інжекцій води у колонки, де фаза не повністю зв’язана, нижче наведені кілька виключень:
- Пористі полімерні колонки PLOT. Ці колонки також мають назву Rt-Q-Bond, Rt-QS-Bond, Rt-S-Bond, та Rt-U-Bond, і вода їх не зруйнує (чи їх еквівалентів MXT). Однак, ніколине інжектуйте воду в колонку Alumina чи молекулярні сита PLOT. Вони вбирають воду, що призводить до втрати розділення та утримання сполук.

- Якщо вам необхідно використовувати незв’язані, частково зв’язані чи високополярні колонки для інжекцій води, переконайтеся, що температура колонки достатньо висока (вище 80°C) для запобігання утворення конденсату всередині колонки, чи використайте полярну деактивовану передколонку перед аналітичною. Таким чином ви забезпечите потрапляння в колонку лише випарів води.
Полярні деактивовані кварцеві передколонки
Як згадувалося раніше, власне сама вода зазвичай не руйнує найбільш зв’язані фази колонок, нелеткі компоненти у водних зразках, включаючи тверді частки, солі, цукри, розчинені солі металів та/або зважені частки металів, що, в свою чергу, можуть призвести до деградації колонки чи негативно вплинути на її продуктивність. Якщо ви помічаєте різке погіршення хроматограми при аналізі водних зразків, уточніть, чи не є нелеткі домішки причиною проблеми (перевірте інжекційний порт та лайнер на наявність їх залишків), а також проведіть відповідні дії для видалення будь-яких домішок зі зразка/екстракту перед інжекцією. Цього можна досягти за допомогою очистки/фільтрації при підготовці зразку. Якщо ви не маєте можливості очистити/профільтрувати ваш зразок перед інжекцією, використайте деактивовану скловату чи лайнер зі скловатою Carbofrit.

Отже, якщо вам необхідно зробити водну інжекцію безпосередньо в колонку, використовуйте полярну деактивовану передколонку навіть з повністю зв’язаною стаціонарною фазою. Ця передколонка (утримуюча пастка) покращить змочуваність при використанні неполярної стаціонарної фази і утримає всі нелеткі залишки поза всіма колонками, незалежно від фази.
Також ми б хотіли додати кілька тез щодо аналізу водних зразків через шприцеві інжекції.
- по-перше, це завжди ризик. Вода розширюється більше, ніж у 1400 разів, коли випаровується, тому завжди ставте найменш можливий об’єм інжекції (0.5 мкл чи менше) у найбільший внутрішній діаметр інжекційного порту, доступний у вашій моделі ГХ;
- по-друге, ми завжди рекомендуємо інжекцію води з режимом split (з найбільш можливою щілиною) замість режиму splitless (чи безпосереднього вводу);
- і наостанок, використовуйте газощільні шприци з плунжером PTFE для кращої відтворюваності.
Сподіваємося, ця інформація буде цінною і захистить вашу колонку від впливу факторів, які ви можете контролювати. Також, гадаємо, вам буде корисно ознайомитися з нашою статтею про те, як правильно вибрати колонку для газової хроматографії.


