Большинство аналитиков уже знают, что повышенные температуры, как и наличие кислорода, разрушают стационарную фазу колонки изнутри. Однако есть несколько мало известных «убийц» капиллярных колонок, таких как pH образца, реагенты для дериватизации, содержание серы, а также водные инжекции. Ниже рассмотрим подробнее эти показатели.
Хотя количественных данных для подтверждения этих рекомендаций нет, нижеследующая информация базируется на собственном опыте и отзывах опытных аналитиков. Эти четыре показателя ни в коем случае не исчерпывающие, но мы надеемся, что перед следующей инжекцией образца вы остановитесь и подумаете, что конкретно вводите в капиллярную колонку.

Экстремальное значение pH образца
Значение pH образца/экстракта, инжектируемого в капиллярную колонку ГХ, может потенциально вызвать разрушение стационарной фазы и/или деактивированного слоя внутри кварцевой трубки, если будет находиться вне диапазона рН от 5 до 9. Уровень рН вне этого диапазона способствует быстрому разрушению колонки и худшим хроматограммам. Чем дальше рН образца/экстракта находится вне «безопасных» значений, тем быстрее возникнет повреждение.
Если вы подозреваете, что образец/экстракт может иметь такой рН, используйте лакмусовую ленту для проверки.
Если вы обнаружите, что pH образца/экстракта выходит за пределы этого диапазона, то все равно можете проанализировать образец, но вам следует отрегулировать его так, чтобы pH попадал в диапазон 5-9. Это можно сделать несколькими разными способами, но, безусловно, лучший способ разбавить образец/экстракт.

Для анализа основных соединений применяются колонки Rtx-Volatile Amine, Rtx-5 Amine, Rtx-35 Amine и Stabilwax-DB, где рН рекомендуется в диапазоне 7-9. Для анализа кислотных соединений для колонок Stabilwax-DA рекомендуется диапазон pH 5-7.
Реагенты для дериватизации

Дериватизационные реагенты обычно применяются в газовой хроматографии для превращения нелетучих соединений в летучие методом замещения определенных функциональных групп другими. Дериватизация может также применяться для повышения термической устойчивости соединений и/или отклика детектора.
Однако, прежде чем вы начнете новый проект, задумайтесь вот о чем.

По этой причине многие методы требуют испарения до высыхания для удаления добавленного дериватизационного реагента. После испарения остаток образца можно растворить в чистом растворителе перед анализом.
Одни из наиболее разрушительных дериватизационных реагентов – это реагенты для ацилирования ангидрида перфторкислоты.
- трифтороцтовый ангидрид (TFAA);
- пентафторпропионовый ангидрид (PFPA);
- гептафтормасляный ангидрид (HFBA).
Эти реагенты формируют из кислоты побочные продукты, атакующие стационарную фазу колонки. Силиловые реагенты трифторуксусной кислоты (TFA) и диметилдихлорсилан (DMDCS) особенно разрушают стационарную фазу полиэтиленгликоль (колонки Carbowax), но гораздо менее вредны для полисилоксановых стационарных фаз. Как и многие силиловые реагенты, производные TMS реагируют с активными атомами водорода, поэтому при анализе этих экстрактов образцов следует избегать использования колонок со стационарной фазой из полиэтиленгликоля (Carbowax).
В то время как большинство дериватизационных агентов разрушают колонку, есть несколько исключений, присутствие которых почти не навредит стационарной фазе капиллярной колонки. Среди таких исключений:
- реагенты для ацилирования N-метилбис трифторацетамида (MBTFA);
- перфторацилимидазолы (трифторацетилимидазол (TFAI), пентафторпропанилимидазол (PFPI), гептафторбутирилимидазол (HFBI)).

Так как нет полного перечня «безопасных» или «разрушающих» дериватизационных реагентов, мы рекомендуем использовать их осторожно при анализе образцов, которые были обработаны любым деривативным реагентом. Если вы заметили спад в хроматографии при анализе дериватизированного образца, возможно, следует пользоваться другим деривативным реагентом.
Элементная сера

Либо аналитики годами знали, что это соединение было в их образцах/экстрактах, либо они были удивлены, когда наконец узнали, что это соединение ухудшало хроматографический анализ.
Многие образцы, особенно нефтепродукты, могут содержать элементную серу. Это не новость, поскольку многие источники серы поступают из природного газа и нефтепродуктов (Sulfur). Другие подобные образцы окружающей среды, которые могут содержать высокий уровень серы, это морские отложения и сточные воды.
Хотя элементная сера не разрушит колонку сразу, она может накапливаться в фазе, а удалить ее оттуда очень трудно. Сера очень активна, и как только фаза колонки загрязняется ею, это может стать причиной адсорбции и разрушения активных соединений в следующих образцах. Это особенно актуально для пестицидов.
EPA известно уже много лет, что образцы, загрязненные серой, могут вызвать проблемы с анализом такого образца. Три наиболее распространенных метода, где они упоминают это: 8081A, 8082A и 8141A. Образцы, где подозревают наличие элементной серы, рекомендуют обработать активированной медью или раствором сульфита тетрабутиламония. Подробности по удалению серы из образцов приведены в методе US EPA 3660B .

В дополнение к данному методу следует отметить, что метод EPA 3640A (очистка GPC) также применим для удаления серы из образцов, и во многих случаях он не имеет нежелательных химических реакций. Однако, если интересующее соединения элюируется из колонки GPC одновременно с серой, необходимо рассмотреть другие процедуры очистки.
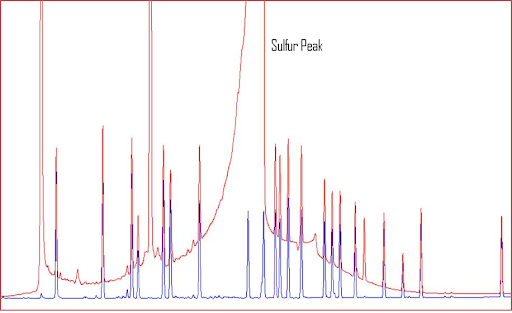
Ниже на примере хроматограммы показан пик сульфура (предоставлена Джеком Кохраном (Jack Cochran)). Красная хроматограмма показывает образец перед очищением, а голубая – после очищения. Он также уточнил, что определяемые соединения были хлорорганическими пестицидами, а детектор – ЭЗД. Как вы видите, этот огромный пик серы не только может усложнить количественное определение целевых соединений, но, как упоминалось ранее, он может сделать вашу колонку очень благоприятной для образования химических реакций.
Конечно, бывают ситуации, когда целью анализа является поиск и количественное определение элементной серы. Несколько методов ASTM были созданы конкретно для количественного определения элементной серы в нефтяных продуктах. Еще раньше были разработаны методы поиска элементной серы и других серосодержащих соединений в гипсокартоне. Постер EPA по ссылке имеет примеры нескольких хроматограмм, где показан пик серы на ЭЗД – анализ элементной серы в гипсокартоне методом ГХ/ЭЗД.
В качестве вывода можно добавить, если у вас есть проблемы с хроматограммой, например, «хвостовые» пики, потери или уменьшение количества целевых соединений, и не объясняемые контаминанты («холмы») после анализа нефтяных продуктов, морского осадка или промышленных сливов, это может быть отрицательным эффектом присутствия элементной серы в образце/экстракте. Чтобы пики были острыми, а колонка прослужила дольше, потратьте немного времени, чтобы удалить это соединение из вашего образца/экстракта перед анализом.
Водные инжекции
Существует много ошибочных представлений о водных инжекциях в ГХ – и не без причины. Несмотря на общие правила, что электроника и вода не должны совмещаться, многие аналитики все же проводят подобные эксперименты. Из-за большого количества звонков по водным инжекциям компания Restek создала перечень часто задаваемых вопросов и ответов.
FAQ: Могу ли я инжектировать воду в мою колонку? Это испортит ее или нет?
Когда дело доходит до водных инжекций, не беспокойтесь, поскольку большинство полностью связанных полимерных фаз капиллярных колонок не будет повреждено.

Чтобы подтвердить, что ваша колонка имеет полностью связанную фазу, внимательно прочтите описание продукта, предоставляемого производителем. В общем, все колонки Restek, начинающиеся на Rtx-___, Stx-___ или Rxi-___, являются полностью связанной фазой. Кроме того, большинство колонок MXT также предлагаются со связанной фазой. Однако колонки Restek, начинающиеся на Rt-___, таковыми не являются.
В то время как существует общее правило избегать инжекций воды в колонки, где фаза не полностью связана, ниже приведены несколько исключений:
- Пористые полимерные колонки PLOT. Эти колонки также называются Rt-Q-Bond, Rt-QS-Bond, Rt-S-Bond, и Rt-U-Bond, и вода их не разрушит (или их эквиваленты MXT). Но никогда не инжектируйте воду в колонку Alumina или молекулярные сита PLOT. Они впитывают воду, что приводит к потере разделения и содержания соединений.

- Если необходимо использовать несвязанные, частично связанные или высокополярные колонки для инжекций воды, убедитесь, что температура колонки достаточно высока (выше 80°C) для предотвращения образования конденсата внутри колонки или используйте полярную деактивированную передколонку перед аналитической. Таким образом, вы обеспечите попадание в колонку только испарений воды.
Полярные деактивированные кварцевые предколонки
Как упоминалось ранее, сама вода обычно не разрушает наиболее связанные фазы колонок, нелетучие компоненты в водных образцах, включая твердые частицы, соли, сахара, растворенные соли металлов и/или взвешенные частицы металлов, что, в свою очередь, могут привести к деградации колонки или негативно повлиять на ее производительность. Если вы заметите резкое ухудшение хроматограммы при анализе водных образцов, уточните, не являются ли нелетучие примеси причиной проблемы (проверьте инжекционный порт и лайнер на наличие их остатков), а также проведите соответствующие действия для удаления любых примесей из образца/экстракта перед инжекцией. Этого можно достичь с помощью очистки/фильтрации при подготовке образца. Если вы не имеете возможности очистить/профильтровать ваш образец перед инжекцией, используйте деактивированную стекловату или лайнер со стекловатой Carbofrit.

Все, что было написано до этого момента, предполагает, что вы инжектируете воду в нагретый split/splitless порт (содержит деактивированный стеклянный лайнер) и производите инжекцию в режиме split.
Другие инжекции могут быть более сложными при анализе водных образцов. К примеру, инжекция непосредственно в колонку. Сервисные инженеры никогда не рекомендуют проводить инжекции аква образцов конкретно в колонку. В то время как одни аналитики совсем не испытывают проблем с получением хороших хроматограмм и воспроизведением результатов при проведении водных инжекций непосредственно в колонку, большинство специалистов испытывают слишком много трудностей, которые, кажется, невозможно исправить. Это особенно заметно на инжекциях непосредственно в колонку, что возможно только при нагреве печи ГХ (и не нагревается самостоятельно).
Итак, если вам необходимо произвести водную инжекцию непосредственно в колонку, используйте полярную деактивированную предколонку даже с полностью связанной стационарной фазой. Эта предколонка (удерживающая ловушка) улучшит смачиваемость при использовании неполярной стационарной фазы и удержит все нелетучие остатки вне всех колонок, независимо от фазы.
Также мы хотели бы добавить несколько тезисов по поводу анализа водных образцов через шприцевые инжекции.
- во-первых, это всегда риск. Вода расширяется более чем в 1400 раз, когда испаряется, поэтому всегда ставьте наименее возможный объем инжекции (0.5 мкл или менее) в наибольший внутренний диаметр инжекционного порта, доступный в вашей модели ГХ;
- во-вторых, мы всегда рекомендуем инжекцию воды с режимом split (с наиболее возможной щелью) вместо режима splitless (или непосредственного ввода);
- и напоследок, используйте газоплотные шприцы с плунжером PTFE для лучшей воспроизводимости.
Надеемся, эта информация будет ценна и защитит вашу колонку от воздействия факторов, которые вы можете контролировать. Также, полагаем, вам будет полезно ознакомиться с нашей статьей о том, как правильно выбрать колонку для газовой хроматографии.


