Інфрачервона спектроскопія з Фур’є-перетворенням (ІЧ-Фур’є) є одним з найуніверсальніших аналітичних інструментів, що використовується в різних напрямках. Ця техніка давно зарекомендувала себе як потужний аналітичний метод для дослідження вторинної структури білка та конформаційних змін. Існує дві основні форми вторинної структури: α-спіраль і β-лист, названі так за моделями водневих зв’язків між атомами водню аміну та атомами кисню карбоніла, які створюють пептидну основу білка.
Розуміння вторинної структури білка є важливим для отримання уявлення про конформацію та стабільність білка. Наприклад, залежний від температури аналіз вторинної структури має вирішальне значення для визначення умов зберігання для збереження активних терапевтичних білків.
У таблиці 1 показано розподіл смуг вторинної структури для білків у воді. Зауважте, що всі розподіли зображені у вигляді діапазону, оскільки точне положення кожного піку варіюється від білка до білка через відмінності у взаємодії водневих зв’язків та середовища оточення білків.
| Вторинна структура | Розподіл піків у воді |
| α-спіраль | 1648-1657 см-1 |
| β-Лист | 1623-1641 см-1 |
| β-Лист
(високочастотна складова) |
1674-1695 см-1 |
| Випадкова | 1642-1657 см-1 |
| Спіралі | 1662-1686 см-1 |
Таблиця 1. Характерні інфрачервоні смуги пептидного зв’язку.
Завдяки широкому спектру методів відбору зразків, включаючи спектроскопію в режимі пропускання, ППВВ, відбиття і поглинання (IRRAS), ІЧ-Фур’є має особливу перевагу з точки зору своєї універсальності і загальної вживаності в порівнянні з іншими аналітичними методами для аналізу вторинної структури білка. Форми зразків білків, придатні для ІЧ-Фур’є аналізу, включають ліофілізовані порошки, водні розчини і колоїди.
Для отримання точних даних методом ІЧ-Фур’є спектроскопії процес потребує ретельного і винахідливого виконання, що включає процедури підготовки зразків, зняття спектрів, аналізу даних і всі можливі запобіжні заходи під час експерименту. На схемі нижче (рис. 1) наведена послідовність етапів ІЧ-Фур’є аналізу, який забезпечує виконання процесу таким чином, щоб забезпечити їхнє правильне виконання.
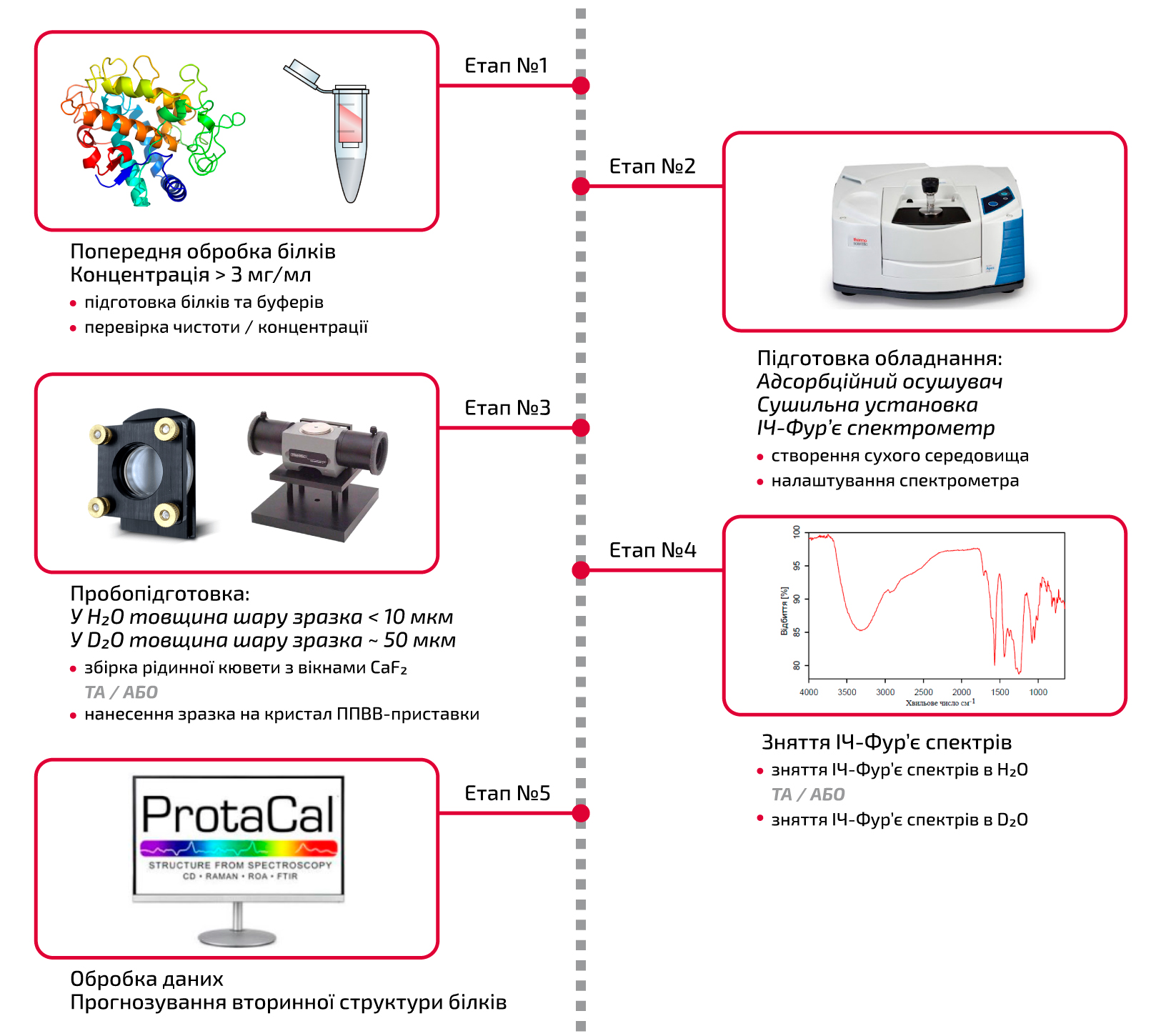
Рисунок 1. Схематичний огляд процесу аналізу білків методом ІЧ-Фур’є спектроскопії
ІЧ-Фур’є спектрометри Thermo Scientific™ Nicolet™ Apex та Nicolet™ iS50 є універсальними аналітичними інструментами, що дозволяють проводити дослідження білків з використанням різноманітних аксесуарів.
Для аналізу білків у режимі пропускання необхідне використання рідинної кювети. Оскільки вода має значний пік поглинання в області 1645 см-1, для уникнення піків насиченої води на спектрі необхідно досягти невеликої довжини оптичного шляху – 6 мкм. При цьому найкращими для аналізу зразків на водній основі є вікна CaF2.На рисунку 2 показано співставлення трьох ІЧ-спектрів: фосфатного буфера, цитохрому С з концентрацією 6 мг/мл та 12 мг/мл у фосфатному буфері, відповідно. На перший погляд, у спектрах переважають смуги води. Ці три спектри мало чим відрізняються, навіть при високій концентрації білка – 12 мг/мл. Дані були отримані у режимі пропускання з використанням рідинної кювети з вікнами CaF2 на ІЧ-Фур’є спектрометрі Nicolet Apex, оснащеним детектором DTGS. Параметри сканування становили 256 сканувань з роздільною здатністю 4 см-1.
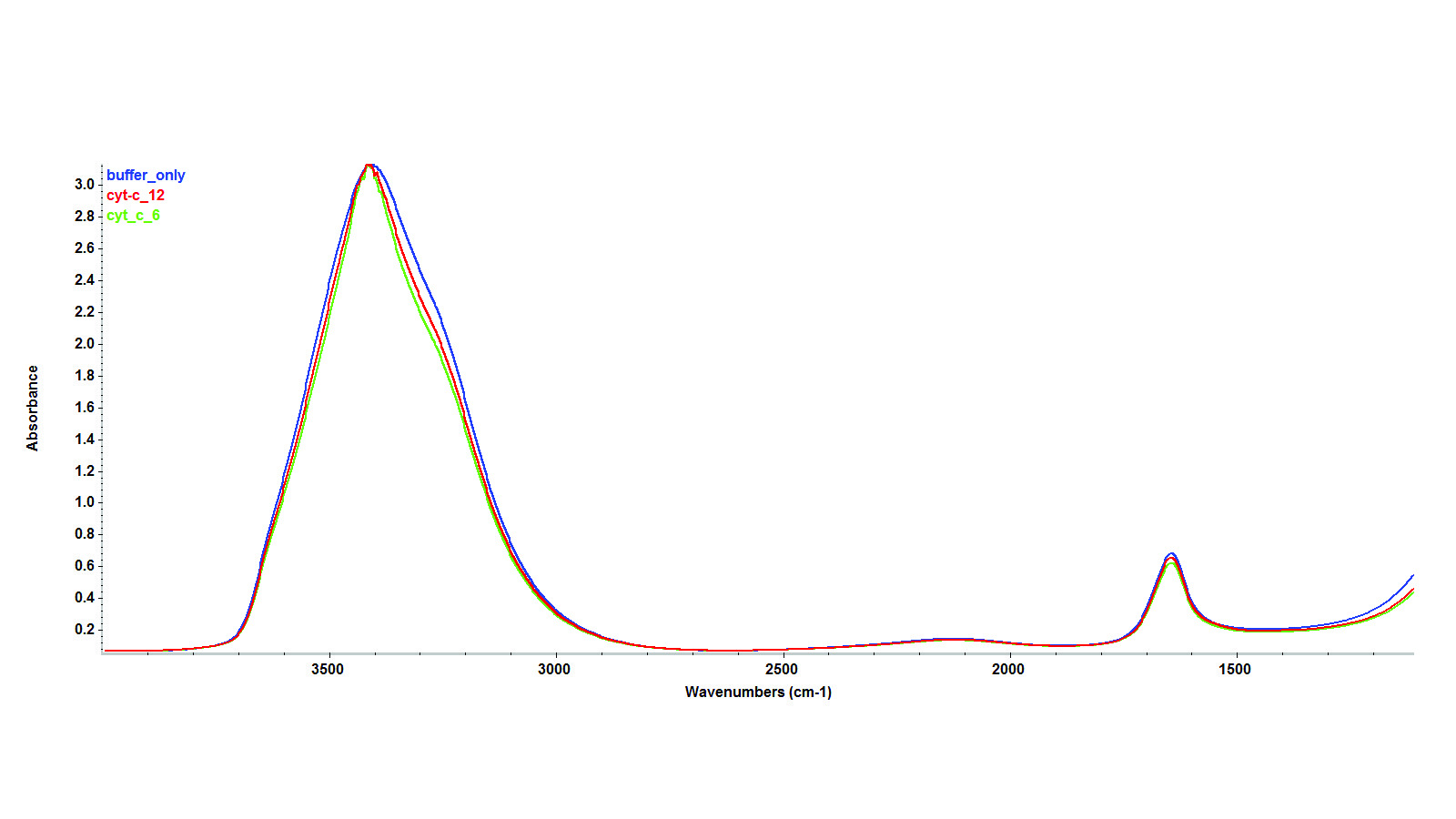
Рисунок 2: ІЧ-Фур’є спектри отримані у режимі пропускання для цитохрому С у фосфатному буфері (cytc_12) при концентраціях 12 мг/мл та 6 мг/мл (cytc_6), а також без фосфатного буферу.
Для отримання інформативного спектру необхідно вилучити з нього спектральні дані буферу. Це можна зробити за допомогою спеціалізованого програмного забезпечення для дослідження білків ProtaCal. На рисунку 3a (цитохром С) і 3b (конканавалін A) показано результати спектральної обробки за допомогою ПЗ ProtaCal. Таким чином, отримали спектри цитохрому С та конканаваліну A з чіткими піками аміду І та аміду ІІ.
Маючи ці дані, можна провести прогнозування вторинної структури аналізованих білків також використовуючи програму ProtaCal. Результати наведені у таблиці 2.
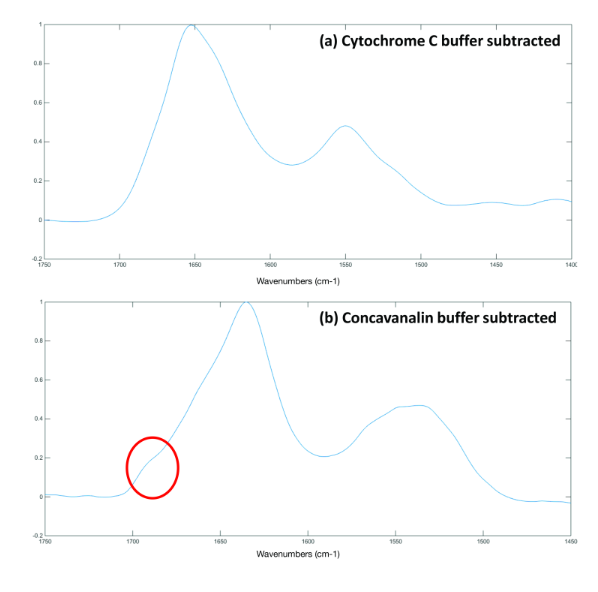
Рисунок 3: ІЧ-спектри (а) цитохрому С та (b) конканаваліну А після віднімання буферного спектру за допомогою програмного забезпечення ProtaCal.
| Білок | α-спіраль (%) | β-лист (%) | Випадкова (%) |
| Цитохром С | 45 | 5 | 50 |
| Конканавалін А | 4 | 42 | 54 |
Таблиця 2: Розрахунок вторинної структури за даними ІЧ-Фур’є спектроскопії (FTIR) у програмному забезпеченні ProtaCal.
Коли кількість і концентрація білка обмежені, кращою альтернативою аксесуару для режиму пропускання є спеціалізована ППВВ-приставка з 10-кратним відбиттям та номінальним кутом падіння 45°. Унікальна конструкція цього аксесуара дозволяє проводити прямі визначення білкових порошків, гелів, розчинів, а також білків, висушених на поверхні кристала. При концентруванні білків на поверхні кристала слід з обережністю підходити до вибору буфера, оскільки буфер також буде концентруватися на його поверхні. Можна використовувати ті, які мають мінімальні піки або взагалі не мають в області амідів I і II.
На рисунку 4 показані спектри BSA у фосфатному буфері, висушені на кристалі з розчину 1 мг/мл та отримані у режимі ППВВ на ІЧ-Фур’є спектрометрі Nicolet iS50, оснащеному ртутно-кадмій-телуридним (MCT) детектором. Розчин білка об’ємом 10 мкл у фосфатному буфері висушували на поверхні кристала ППВВ під струменем азоту. Параметри сканування становили 256 сканів з роздільною здатністю 4 см-1.
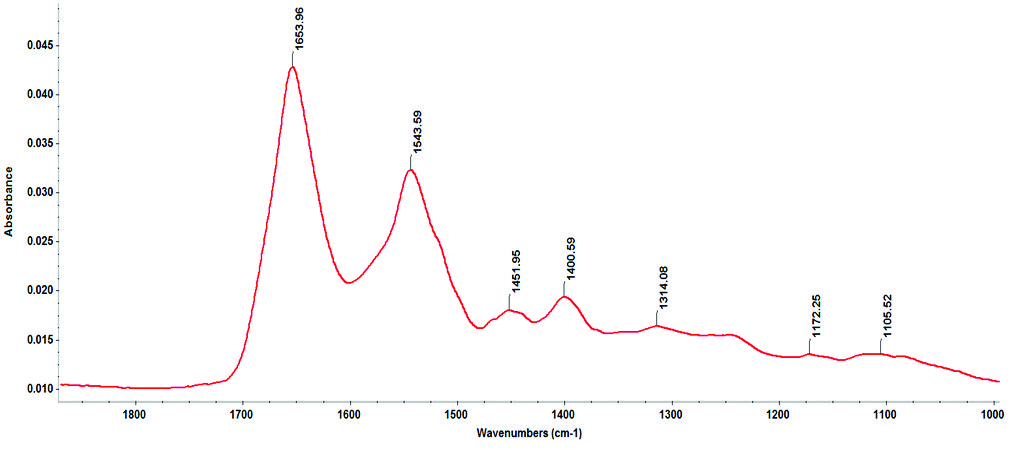
Рисунок 4: Аміди I і II для 1 мг/мл BSA, проаналізовані за допомогою ППВВ-приставки з 10-кратним відбиттям та номінальним кутом падіння 45° на ІЧ-Фур’є спектрометрі Nicolet iS50, оснащеному детектором MCT.
Обробка отриманого спектру була зроблена шляхом деконволюції піку аміду I (рис.5) BSA за допомогою програмного забезпечення OMNIC. Для того, щоб отримати чітку форму піків для їхньої підгонки також була проведена корекція базової лінії в області аміду I. Поправка на базову лінію також ефективно виключила внески з області аміду II. В результаті деконволюції аміду I було отримано 5 піків, площа під кожним піком була оцінена відносно загальної площі. Деконволюція піків аміду I показала, що вторинна структура складається з 47% α-спіралей, 3% β-спіралей, 24% спіралей і 26% випадкових структур, подібно до опублікованих ІЧ-Фур’є та рентгенівських даних.
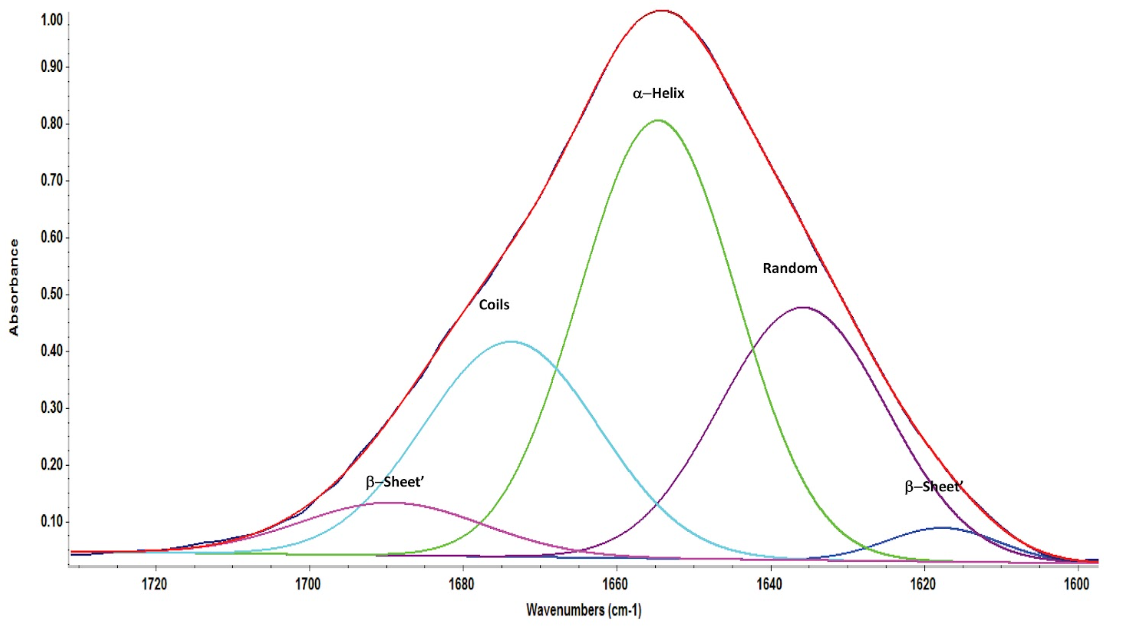
Рисунок 5: Деконволюція піку аміду I BSA за допомогою функції Peak Resolve програмного забезпечення OMNIC.
У цій статті було продемонстровано два приклади дослідження вторинної структури білків за допомогою ІЧ-Фур’є спектроскопії. Цей метод в поєднанні з програмним
забезпеченням ProtaCal дозволяє легко аналізувати вторинну структуру білків у розчині з мінімальною пробопідготовкою зразків. Коли кількість і концентрація білка обмежені, ППВВ-приставка з алмазним кристалом пропонує кращу альтернативу шляхом прямого висушування білків на кристалі та обробки спектральних даних за допомогою програмного забезпечення Omnic.
