Инфракрасная спектроскопия с Фурье-преобразованием (ИК-Фурье) является одним из самых универсальных аналитических инструментов, используемых в различных областях. Эта техника давно зарекомендовала себя как мощный аналитический метод для исследования вторичной структуры белка и конформационных изменений. Существует две основные формы вторичной структуры: α-спираль и β-лист, названные так по моделям водородных связей между атомами водорода амина и атомами кислорода карбонила, которые создают пептидную основу белка.
Понимание вторичной структуры белка важно для получения представления о конформации и стабильности белка. Например, зависимый от температуры анализ вторичной структуры имеет решающее значение для определения условий хранения для сохранения активных терапевтических белков.
В таблице 1 показано распределение полос вторичной структуры для белков в воде. Обратите внимание, что все распределения изображены в виде диапазона, поскольку точное положение каждого пика варьируется от белка к белку из-за различий во взаимодействии водородных связей и окружающей среды белков.
| Вторичная структура | Розподіл піків у воді |
| α-спираль | 1648-1657 см-1 |
| β-Лист | 1623-1641 см-1 |
| β-Лист
(высокочастотная составляющая) |
1674-1695 см-1 |
| Случайная | 1642-1657 см-1 |
| Спирали | 1662-1686 см-1 |
Таблица 1. Характерные инфракрасные полосы пептидной связи.
Благодаря широкому спектру методов отбора образцов, включая спектроскопию в режиме пропускания, ППВВ, отражения и поглощения (IRRAS), ИК-Фурье имеет особое преимущество с точки зрения своей универсальности и общей применимости по сравнению с другими аналитическими методами для анализа вторичной структуры белка. Формы образцов белков, пригодные для ИК-Фурье анализа, включают лиофилизированные порошки, водные растворы и коллоиды.
Для получения точных данных методом ИК-Фурье спектроскопии процесс требует тщательного и изобретательного выполнения, включающего процедуры подготовки образцов, снятия спектров, анализа данных и все возможные меры предосторожности во время эксперимента. На схеме ниже (рис. 1) приведена последовательность этапов ИК-Фурье анализа, которая обеспечивает выполнение процесса таким образом, чтобы обеспечить их правильное выполнение.
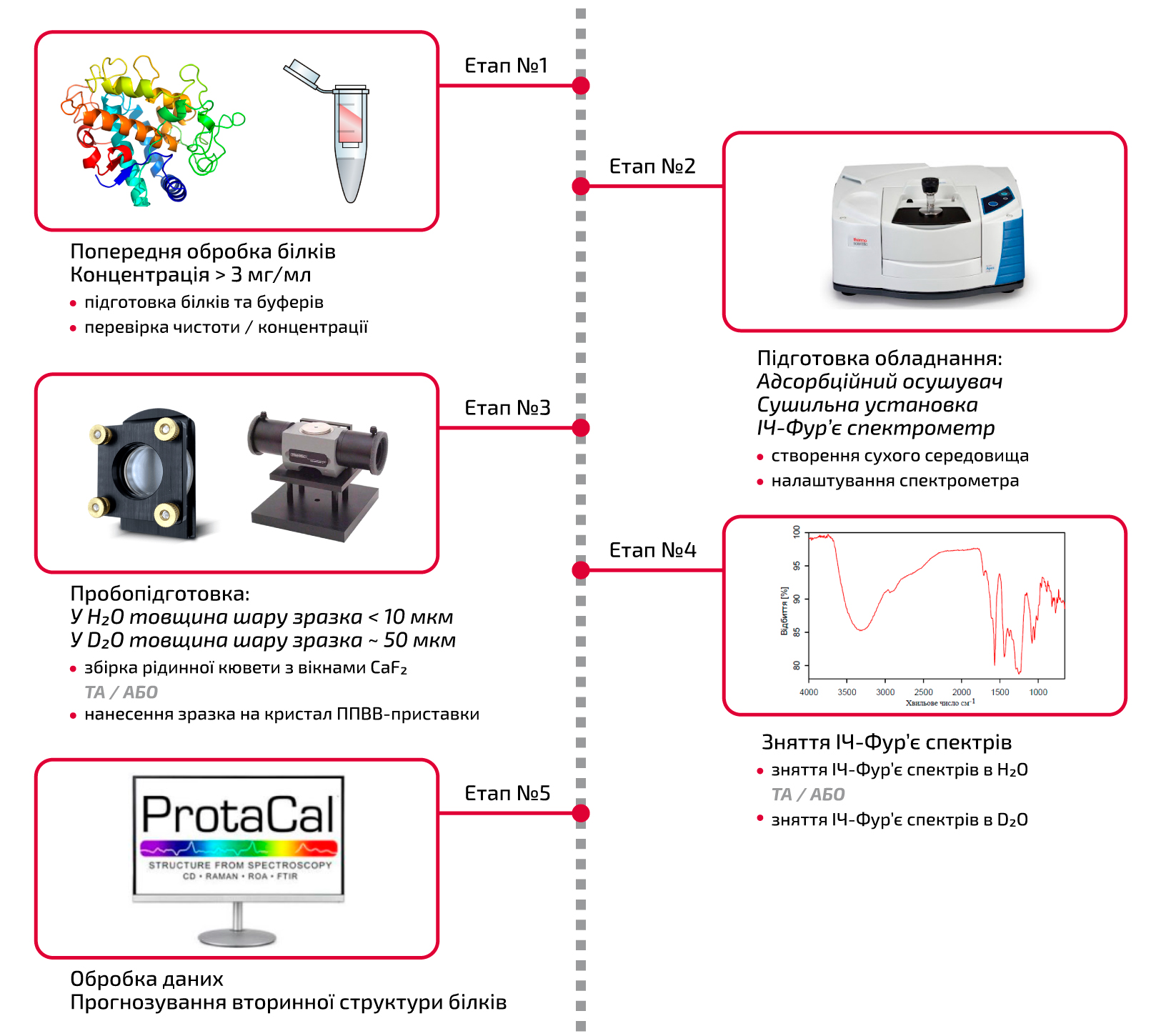
Рисунок 1. Схематический обзор процесса анализа белков методом ИК-Фурье спектроскопии
ИК-Фурье спектрометры Thermo Scientific™ Nicolet™ Apex и Nicolet™ iS50 являются универсальными аналитическими инструментами, позволяющими проводить исследования белков с использованием различных аксессуаров.
Для анализа белков в режиме пропускания необходимо использование жидкостной кюветы. Поскольку вода имеет значительный пик поглощения в области 1645 см-1, для избежания пиков насыщенной воды на спектре необходимо достичь небольшой длины оптического пути – 6 мкм. При этом лучшими для анализа образцов на водной основе являются окна CaF2.
На рисунке 2 показано сопоставление трех ИК-спектров: фосфатного буфера, цитохрома С с концентрацией 6 мг/мл и 12 мг/мл в фосфатном буфере, соответственно. На первый взгляд, в спектрах преобладают полосы воды. Эти три спектра мало чем отличаются, даже при высокой концентрации белка – 12 мг/мл. Данные были получены в режиме пропускания с использованием жидкостной кюветы с окнами CaF2 на ИК-Фурье спектрометре Nicolet Apex, оснащенном детектором DTGS. Параметры сканирования составляли 256 сканирований с разрешением 4 см-1.
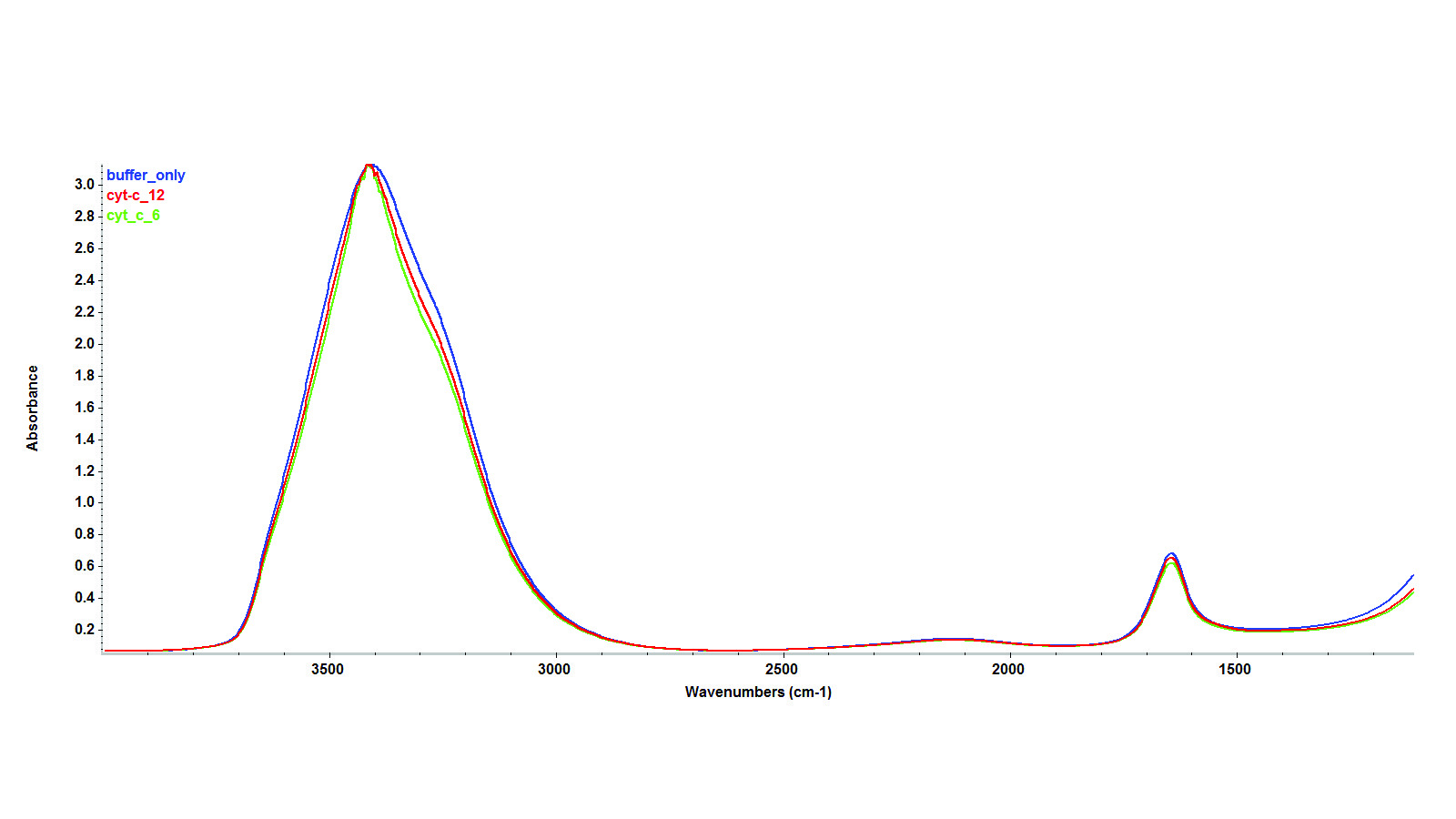
Рисунок 2: ИК-Фурье спектры, полученные в режиме пропускания для цитохрома С в фосфатном буфере (cytc_12) при концентрациях 12 мг/мл и 6 мг/мл (cytc_6), а также без фосфатного буфера.
Для получения информативного спектра необходимо удалить из него спектральные данные буфера. Это можно сделать с помощью специализированного программного обеспечения для исследования белков ProtaCal. На рисунке 3a (цитохром С) и 3b (конканавалин A) показаны результаты спектральной обработки с помощью ПО ProtaCal. Таким образом, были получены спектры цитохрома С и конканавалина A с четкими пиками амида I и амида II.
Имея эти данные, можно провести прогнозирование вторичной структуры анализируемых белков, также используя программу ProtaCal. Результаты приведены в таблице 2.
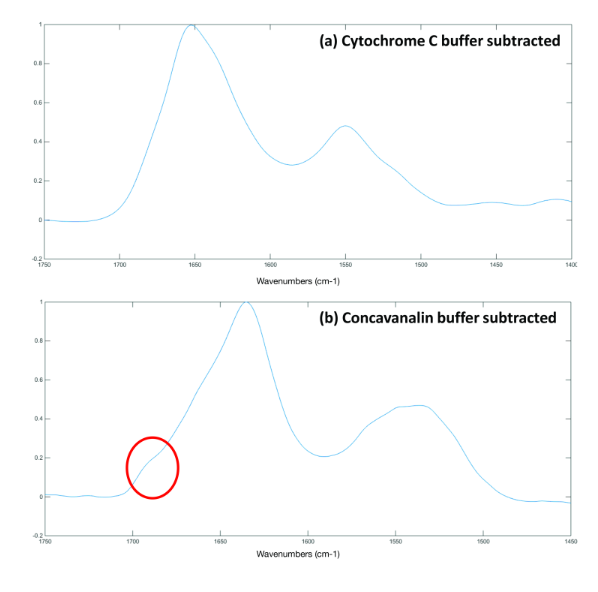
Рисунок 3: ИК-спектры (а) цитохрома С и (b) конканавалина А после вычитания буферного спектра с помощью программного обеспечения ProtaCal.
| Белок | α-спираль (%) | β-лист (%) | Случайная (%) |
| Цитохром С | 45 | 5 | 50 |
| Конканавалин А | 4 | 42 | 54 |
Таблица 2: Расчет вторичной структуры по данным ИК-Фурье спектроскопии (FTIR) в программном обеспечении ProtaCal.
Когда количество и концентрация белка ограничены, лучшей альтернативой аксессуару для режима пропускания является специализированная ППВВ-приставка с 10-кратным отражением и номинальным углом падения 45°. Уникальная конструкция этого аксессуара позволяет проводить прямые определения белковых порошков, гелей, растворов, а также белков, высушенных на поверхности кристалла. При концентрировании белков на поверхности кристалла следует с осторожностью подходить к выбору буфера, поскольку буфер также будет концентрироваться на его поверхности. Можно использовать те, которые имеют минимальные пики или вообще не имеют в области амидов I и II.
На рисунке 4 показаны спектры BSA в фосфатном буфере, высушенные на кристалле из раствора 1 мг/мл и полученные в режиме ППВВ на ИК-Фурье спектрометре Nicolet iS50, оснащенном ртутно-кадмий-телуридным (MCT) детектором. Раствор белка объемом 10 мкл в фосфатном буфере высушивали на поверхности кристалла ППВВ под струей азота. Параметры сканирования составляли 256 сканов с разрешением 4 см-1.
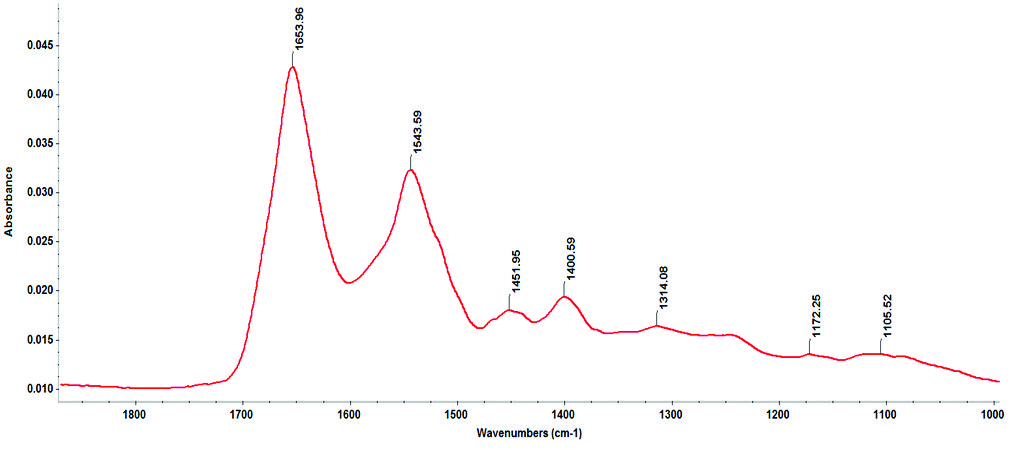
Рисунок 4: Амиды I и II для 1 мг/мл BSA, проанализированные с помощью ППВВ-приставки с 10-кратным отражением и номинальным углом падения 45° на ИК-Фурье спектрометре Nicolet iS50, оснащенном детектором MCT.
Обработка полученного спектра была выполнена путем деконволюции пика амида I (рис. 5) BSA с помощью программного обеспечения OMNIC. Для того, чтобы получить четкую форму пиков для их подгонки, также была проведена коррекция базовой линии в области амида I. Поправка на базовую линию также эффективно исключила вклады из области амида II. В результате деконволюции амида I было получено 5 пиков, площадь под каждым пиком была оценена относительно общей площади. Деконволюция пиков амида I показала, что вторичная структура состоит из 47% α-спиралей, 3% β-спиралей, 24% спиралей и 26% случайных структур, подобно опубликованным ИК-Фурье и рентгеновским данным.
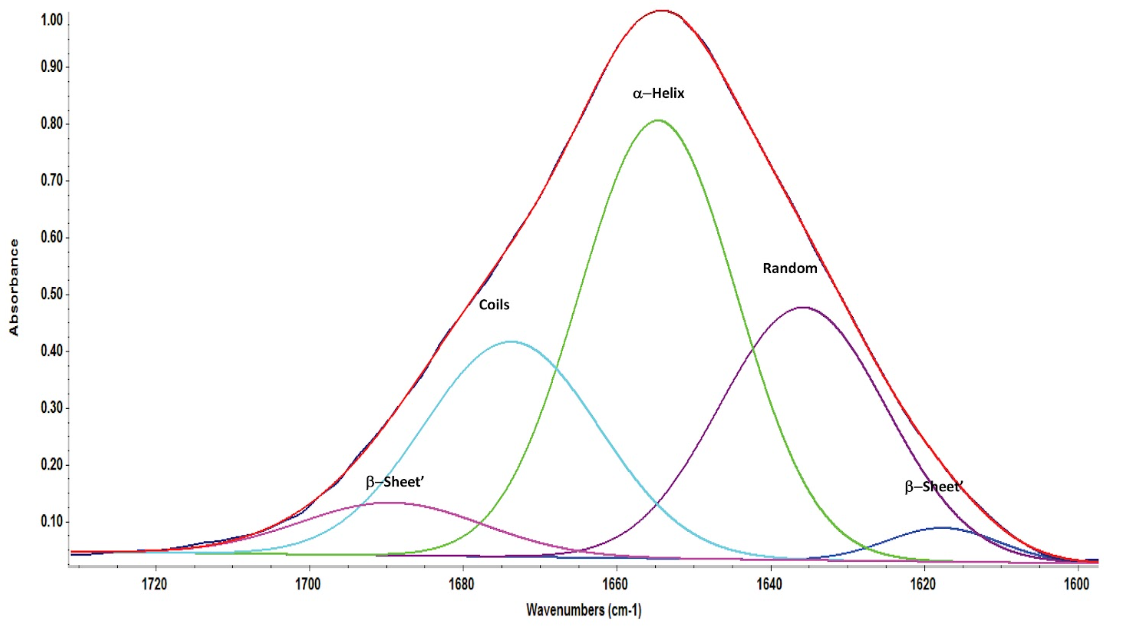
Рисунок 5: Деконволюция пика амида I BSA с помощью функции Peak Resolve программного обеспечения OMNIC.
В этой статье было продемонстрировано два примера исследования вторичной структуры белков с помощью ИК-Фурье спектроскопии. Этот метод в сочетании с программным
обеспечением ProtaCal позволяет легко анализировать вторичную структуру белков в растворе с минимальной пробоподготовкой образцов. Когда количество и концентрация белка ограничены, ППВВ-приставка с алмазным кристаллом предлагает лучшую альтернативу путем прямого высушивания белков на кристалле и обработки спектральных данных с помощью программного обеспечения Omnic.
