Творця літератури з саморозвитку Олівера Наполеона Хілла (1883-1970) одного разу описали як «найвідомішого шахрая, про якого ви, ймовірно, ніколи не чули». Однак, відоме його висловлювання, яке звучить так «той, хто намагається отримати щось даром, зазвичай нічого не отримує навіть за щось», здається, дуже яскраво описує процес підготовки зразків для хроматографії.
Дослідники та їхні клієнти часто обговорюють бажання «зберегти простоту екстракції», прагнення «переконатися, що метод екстракції є швидким, надійним» та «економічно ефективним, оскільки у нас багато зразків для обробки». Крім того, вони нарікають, що межі виявлення виглядають недостатніми, специфічність експерименту не висока, є проблеми з коелюцією, а при проведенні рідинної хроматографії з тандемною мас-спектрометрією (РХ-МС) виникають матричні ефекти. Варто нагадати колегам, що досягнення швидкого, дешевого і повного результату вимагає величезних ресурсів, але вони можуть лише сказати, що у них «не так багато часу на проведення дослідження».
Проте, в залежності від аналітичних цілей дослідження, існують методи, які при правильній оптимізації, дозволять знайти той самий «Святий Грааль» недорого і швидко. Щоб ефективно їх впроваджувати й використовувати, потрібно знати передумови, на яких ці методи базуються. Дана робота містить опис принципів оптимізації, можливо, найпростішого з усіх методів екстракції – рідинно-рідинної екстракції (liquid–liquid extraction, LLE), також відомого як поділ розчинником.
Незалежно від того, яку «версію» LLE передбачається використовувати, всі вони мають загальні поняття, найважливішим з яких, можливо, є інформація про фізико-хімічні властивості аналізованої речовини. Відомо, що для нейтральних молекул коефіцієнт поділу води і органічного розчинника безпосередньо пов’язаний з кислотністю водневого зв’язку аналіту, основністю водневого зв’язку, біполярністю, поляризовністю і молярним об’ємом. Для іонізованих зразків потрібно, принаймні, ще один дескриптор, пов’язаний з властивостями іонної форми. Однак досвід деяких дослідників вказує на те, що такого роду припущення рідко використовуються на практиці – зазвичай застосовується метод проб і помилок в поєднанні з різними комбінаціями розчинників.
Розуміння фізико-хімічних параметрів аналіту
Для досягнення максимальної селективності та вилучення необхідно забезпечити максимально ефективний поділ цільових аналітів при їх переході з однієї фази в іншу, що в більшості випадків підкріплюється деякою простою фізико-хімічною інформацією, зокрема:
- коефіцієнт поділу LogP (D) (істотно);
- константа дисоціації кислоти pKa (потрібна для іонізованих сполук);
- кількість донорів або акцепторів водневих зв’язків (корисно);
- питомий об’єм (зворотний щільності) (м3/кг) (корисно).
Наприклад, ось дані для молекули катинона, яка є іоногенною речовиною, як показано на малюнку 1:
- LogD (pH10) = 1,18
- LogD (pH2) = -1,86
- pKa = 7,55
- Число донорів водневого зв’язку 1
- Питомий об’єм 0,91
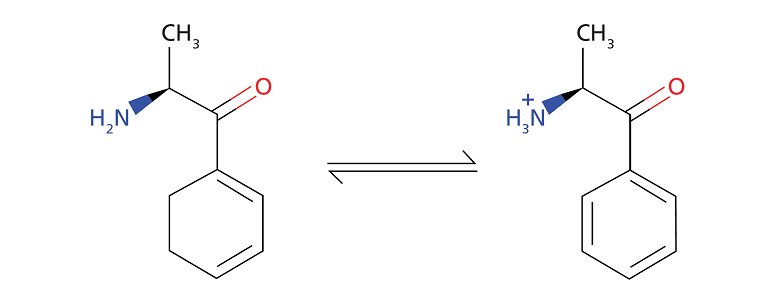
Малюнок 1. Динамічна рівновага цільового аналіту катінона.
Ця інформація доступна в різних джерелах, серед яких при підготовці даної публікації широко використовувалися наступні:
- Chemspider (Королівське хімічне товариство, Великобританія);
- Chemicalize (угорської компанії ChemAxon);
- База даних UFZ-LSER;
- MarvinSketch (угорської компанії ChemAxon, зокрема, дозволив обчислити значення для аналітів, яких не було в попередніх базах даних).
Як цю інформацію можна використовувати для розробки та оптимізації дослідження методом рідинно-рідинної екстракції? Першою дією при проектуванні будь-якої рідинної екстракції є вибір екстрагувального розчинника, що обумовлено відносною гідрофобністю молекули аналіту, яку відобиває його значення logP(D).
У якості короткого нагадування, поведінка поділу аналіту між двома фазами буде відбиватися в значеннях logP (Таблиця 1).
Таблица 1. Распределение фаз аналита при различных значениях logP
| Значення logp аналіту | Співвідношення органічний розчинник: вода |
| 10 | 100:1 |
| 1 | 10:1 |
| 0 | 1:1 |
| -1 | 1:10 |
| -10 | 1:100 |
Як видно з таблиці 1, значення logp аналіту буде вказувати на ступінь вилучення аналіту з водної матриці.
Маніпуляції з рН аналіту
Фізико-хімічні дані катінона вказують на те, що значення logP (D) буде варіюватися в залежності від значення рН розчину зразка. Ця інформація може використовуватися при підготовці дослідження методом рідинно-рідинної екстракції. В цьому випадку підвищення значення водного рН катіона дозволить зробити аналіт нейтральним і помістити його зліва від точки рівноваги. При цьому, значення Logd аналіту (оскільки аналіт іонізується, ми використовували LogD, а не logP, але загальні співвідношення зберігаються) складе 1,18 і розділить зразок на органічну фазу в пропорції 10:1 в залежності від обраного органічного розчинника.
Малюнок 2 вказує співвідношення значень рН і PK розчину і цільові значення рН.
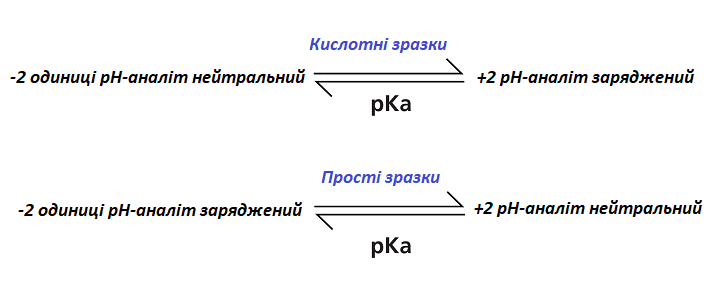
Малюнок 2. Співвідношення значень рН і PK розчину
Зростання значення рН розчину зразка до 9,55 або вище в цільовому катиноновому аналіті забезпечить його нейтральність, а значення LogD дорівнюватиме 1,18. Це дозволить йому більш успішно екстрагуватися з водного зразка в органічний розчинник. Це вказує на важливість знання фізико-хімічних властивостей аналіту при підготовці екстракції. У разі, якщо розчин зразка мав би нейтральний або кислотний рН, коефіцієнт поділу аналізованої речовини був би набагато нижче, і ступінь його вилучення з розчину зразка в екстрагуючий розчинник, відповідно, теж.
У разі, якщо визначити значення pKa і точну структуру аналіту важко, оцінити вплив рН на ефективність екстракції розчинником можна за допомогою наступних передбачуваних значень:
- рН 9 і 11 для передбачуваних основних аналітів;
- рН 6 і 7,5 для передбачуваних нейтральних аналітів;
- рН 2,5 і 4 для передбачуваних кислих аналітів.
Різниця в вилученні аналіту між кожною з пар значень рН іноді може бути досить вражаючою, і ці відмінності обумовлені невідомим PKA аналіту.
Зворотна екстракція
Селективність екстракції, в ході якої змінювалося значення рН зразка, може бути поліпшена за допомогою методу, відомого як зворотна екстракція. Коли цільові аналіти знаходяться в органічній фазі, вони можуть бути повторно екстраговані у водну фазу, значення рН якої було змінено. Це може гарантувати, що аналіти знаходяться в зарядженій формі і, отже, максимально гідрофільні. Значення рН екстрагувального розчину, отриманого в ході зворотної екстракції, може бути змінено до основного – для кислих цільових аналітів, і навпаки – для основних цільових аналітів.
Таким чином, оскільки всі нейтральні екстрагенти залишаються в органічному розчиннику, число випадків спільного елюювання і матричний фон (а, отже, і межі виявлення) знижуються – ефективність екстракції зростає.
Обмежень кількості можливих зворотних екстракцій для підвищення специфічності дослідження немає. Отже, значення рН водного шару може бути знову змінено, аби гарантувати, що аналіт знаходиться в нейтральній формі і екстрагується в органічний розчинник. При цьому, абсолютна концентрація аналіту на кожній стадії зворотної екстракції буде знижуватися відповідно до питомого ступеня поділу, досягнутої на кожній стадії.
Використання солей
Екстракція більш високогідрофільних аналітів з водних проб може бути прискорена шляхом додавання в досліджуваний зразок солей. Тут можна виділити два загальниі підходи:
Якщо значення рН розчину зразка буде змінено так, щоб забезпечити повну іонізацію аналіту, іонно-асоційована сіль з протилежним по відношенню до аналіту зарядом буде робити його нейтральним. Судячи з усього, такий нейтральний комплекс матиме набагато вищий коефіцієнт поділу, ніж іонізований аналіт. Такий метод екстракції може бути використаний, в разі, якщо аналіти кислі або основні.
Додавання простих солей в досить високих концентраціях у водний розчин зразка може істотно збільшити коефіцієнт поділу гідрофільних аналітів і поліпшити екстракцію в органічні екстракційні розчинники. Після додавання в розчин зразка 3-5 М сульфату натрію розчинність аналіту в ньому знижується. Це призводить до переходу цільових аналітів в органічну фазу і зростання ефективності екстракції. Існує безліч солей, які можуть бути використані таким чином. Необхідні їх концентрації для досягнення насичення й оптимального вилучення аналіту можуть бути визначені емпірично.
Вибір екстракційного розчинника
Стан цільових аналітів в ході дослідження методом рідинно-рідинної екстракції значною мірою залежить від вибору органічного розчинника, в який витягається аналіт. Різні розчинники мають різні полярності, і це впливає на їх взаємодію з аналітами. У таблиці 2 перераховані деякі незмішувальні з водою розчинники із зазначенням їх індексу полярності.
Таблиця 2. Значення індексу полярності популярних органічних розчинників, які використовуються при рідинно-рідинної екстракції.
| Розчинник | Індекс полярності |
| Пентан | 0,0 |
| Гептан | 0,1 |
| Толуол | 2,4 |
| Метил-трет-бутиловий ефір (МТБЕ) | 2,5 |
| Хлорбензол | 2,7 |
| Дихлорметан (ДХМ) | 3,1 |
| Бутанол-1 | 3,9 |
| Хлороформ | 4,1 |
| Етилацетат | 4,4 |
| Метилетилкетон (МЕК) | 4,7 |
Більш полярні аналіти (нижчі значення logP (D) також можуть служити хорошим індикатором полярності) можуть вимагати використання органічного розчинника з вищим значенням індексу полярності, що сприятиме оптимізації вилучення аналіту з водної проби в органічний екстрагуючий розчинник. Правила при цьому досить прості – полярність аналіту потрібно зіставити з полярністю екстракційного розчинника. У разі, якщо отримати високий ступінь полярності аналіту неможливо, в якості сурогату може використовуватися зразок з нижчими значеннями logP.
Для подальшого підвищення селективності в якості екстракційного розчинника можуть також використовуватися «змішані» органічні системи. У цьому випадку досліднику потрібно виробити власний оригінальний підхід до екстракції з використанням сумішей розчинників, які довели свою ефективність в конкретній області застосування. Таблиця 3 включає список сумішей розчинників, які можуть виявитися особливо корисними. Для поділу сумішей розчинників зазвичай використовуються 96-лункові лабораторні плашки. Це дозволяє швидко оцінити передбачуваний хід екстракції для великої кількості аналізованих речовин, з різними розчинниками та ступенем рН.
Таблиця 3. Застосовувані суміші розчинників для повнiшого вилучення в процесі рідинно-рідинної екстракції.
| Комбінація розчинників | Співвідношення розчинників |
| Етилацетат / МТБЕ | 1:1 |
| Ацетон / етилацетат / МТБЕ | 1:2:2 |
| ДХМ / МТБЕ / етилацетат | 1:2:2 |
| ДХМ / толуол / МТБЕ | 3:4:3 |
| МТБЕ / толуол | 1:3, 1:1, 3:1 |
| Толуол / бутанол-1 | 1:3, 1:1, 3:1 |
| Бутанол МТБЕ | 1:3, 1:1, 3:1 |
Вибір найбільш ефективної комбінації розчинників залежить від природи аналізованої речовини і числа послідовно повторених процесів екстракції.
Вдосконалені методи вибору розчинників екстракції
Стаття «Рівняння перенесення нейтральних молекул і іонних частинок з води в органічні фази», опублікована в журналі The Journal of Organic Chemistry у 2010 році, описує побудову алгоритму прогнозування ефективності екстракції, заснованого на кількісному співвідношенні значень logP(D) сполук в різних парах розчинників. Майкл Х. Абрахам і Вільям Е. Екрі Мол. досліджували pKa, LogD, кількість груп донорів водневих зв’язків (HBD) і питомий обсяг аналіту для розрахунку коефіцієнта його поділу в різних органічних розчинниках, використовуючи рівняння, яке було отримано з декількох базових вимірювань коефіцієнта поділу.
Існують інші доступні онлайн інструменти для визначення оптимального розчинника для рідинно-рідинної екстракції. Можливо, найкорисніший з них – база даних UFZ-LSER. Застосування системи SMILES для молекули досліджуваного катінону дозволяє обчислити деякі ключові термодинамічні та фізико‑хімічні властивості молекули, які пізніше будуть використовуватися для прогнозування коефіцієнтів поділу між широким спектром органічних розчинників (сумішей розчинників) і водою.
Це дуже корисний інструмент для швидкого визначення органічних розчинників, який може бути використаний в будь-яких експериментах. У даному конкретному прикладі було встановлено, що хлороформ є оптимальним вибором для рідинної екстракції катіона. База даних UFZ-LSER включає широкі відомості про сполучення з відомими значеннями й вказує надійні джерела дескрипторів в мережі, що також підвищує надійність оцінки коефіцієнта поділу. Однак її застосування менш ефективно в разі, коли необхідно обчислити властивості аналізованих речовин.
При виборі екстракційного розчинника завжди потрібно пам’ятати, яким шаром він виступає. Щільність деяких органічних розчинників вище, ніж у води, тому вони будуть займати нижній шар в екстракційній посудині. Ось деякі з таких розчинників (в порядку зростання щільності):
Хлорбензол (C6H5Cl) < 1,2-дихлоретан (C2H4Cl2) < 1,2-дихлорбензол (C6H4Cl2) < дихлорметан (CH2Cl2) < трихлоретилен (C2HCl3) < хлороформ (CHCl3) < тетрахлорметан (CCl4)
Підвищення селективності рідинно-рідинної екстракції
Вибір розчинника завжди впливає на специфічність екстракції, зокрема, на можливість відділення цільових аналітів від компонентів матриці, які можуть мати подібні хімічні та фізико-хімічні властивості. У випадку, якщо для рідинно-рідинної екстракції використовуються прості бінарні системи розчинників, контроль специфічності обмежується вибором органічного розчинника, рН розчину зразка і, можливо, іонною силою. З точки зору селективності при виборі органічного розчинника одним з найважливіших є ступінь розчинності води в органічному розчиннику. Відносна розчинність води в ряді органічних розчинників наведена в таблиці 4.
Таблиця 4. Розчинність у воді популярних органічних розчинників, які використовуються при рідинно-рідинiй екстракції.
| Розчинник | Розчинність при температурі 20°C |
| Пентан | 0,009 |
| Гептан | 0,01 |
| Толуол | 0,033 |
| Метил-трет-бутиловий ефір (МТБЕ) | 1,5 |
| Хлорбензол | 0,04 |
| Дихлорметан (ДХМ) | 0,24 |
| Бутанол-1 | 20,1 |
| Хлороформ | 0,056 |
| Етилацетат | 3,3 |
| Метилетилкетон (МЕК) | 10,0 |
Таблиця 4 вказує на те, що деякі органічні розчинники здатні розчиняти відповідний обсяг води, тому можна очікувати, що вони будуть менш специфічні, ніж ті розчинники, в яких вода демонструє набагато нижчу розчинність. Використання розчинників, які здатні ефективніше розчиняти воду, призводить до отримання екстрактів з вищим вмістом інтерферентів. Для пошуку таких водорозчинних речовин можна скористатися даним ресурсом.
Залежність екстракції від розчинника
З метою домогтися максимального вилучення співвідношення органічного екстракційного розчинника до води в зразку має бути високим (можливо, навіть вище, ніж заведено вважати розумним). Оптимальним на наш погляд може вважатися співвідношення 7:1, але фактичне оптимальне значення залежить від коефіцієнта поділу цільового аналіту (аналітів) між двома розчинниками. База даних UFZ-LSER включає корисний інструмент Extraction tool, який дозволяє оцінити оптимальне співвідношення розчинник/зразок, що може значно заощадити час на емпіричну оцінку зразка. Оптимальне значення для хлороформної екстракції катинону, яка описувалася вище, становить 6:1, що вказує на те, що загальне співвідношення 7:1 близьке до оптимального.
Летючість екстракційного розчинника та аналіту
Летючість екстрагувального розчинника є ще одним важливим фактором при виборі оптимального співвідношення органічний розчинник/вода. Час підготовки зразка зазвичай обмежений часом, за який обсяг органічного розчинника може бути зменшений шляхом випаровування для досягнення такої концентрації, яка відповідає аналітичним межам виявлення. Більш летючі екстракційні розчинники випаровуються швидше, що скорочує загальний час експерименту. При цьому, швидке випаровування може підвищити якісну і кількісну похибку вимірювання. Ретельний вибір розчинників з високою спорідненістю до цільових аналітиків дозволяє використовувати менші обсяги розчинника і, можливо, уникнути необхідності його зайвого випаровування.
Іншим важливим фактором, який часто не помічають, є летючість аналіту. Ідеальний розчинник повинен бути здатний випаровуватися до висихання за досить короткий час (10-15 хв) при нагріванні до 30-40°С.якщо аналіт може витримати ці умови без втрат або деградації, то коефіцієнт поділу буде високим. Чим більш летючий аналіт в цих умовах, тим коефіцієнт поділу буде нижче. Якщо летючість аналіту істотно знижує даний показник, необхідно розглянути можливість використання альтернативного екстракційного розчинника.
Режим змішування і час екстракції
Простий процес екстракції вимагає максимізації межі розділу між двома фазами, що часто вимагає більш інтенсивного перемішування зразка. У сучасній лабораторії ручні струшувальні колби повинні замінюватися на більш дрібні судини, які можна використовувати з орбітальним шейкером або іншими системами автоматизації. Необхідно також оптимізувати інтенсивність змішування зразка, для максимального вилучення аналіту за мінімальний термін. Час екстракції також має бути оптимізовано. Вiн буде залежати від режиму змішування, афінності (коефіцієнта розподілу) екстрагувального розчину для аналізованої речовини й співвідношення проби до екстрагувального розчинника.
При підготовці простого експерименту по рідинно-рідинної екстракції варто враховувати набагато більше факторів, ніж може здатися, на перший погляд. Щоб уникнути прагнення «отримати щось даром» і застосовувати дійсно швидкі, недорогі та ефективні протоколи екстракції потрібні значні зусилля, зокрема, з розробки власних оригінальних дослідницьких методик.


