Создателя литературы по саморазвитию Оливера Наполеона Хилла (1883-1970) однажды описали как «самого известного мошенника, о котором вы, вероятно, никогда не слышали». Однако, известное его высказывание, которое звучит так: «тот, кто пытается получить что-то даром, обычно ничего не получает даже за что-то», кажется, очень ярко описывает процесс подготовки образцов для хроматографии.
Исследователи и их клиенты часто обсуждают желание «сохранить простоту экстракции», стремление «убедиться, что метод экстракции является быстрым, надежным» и «экономически эффективным, поскольку у нас много образцов для обработки». Кроме того, они сетуют, что пределы обнаружения выглядят недостаточными, специфичность эксперимента не высока, есть проблемы с коэлюцией, а при проведении жидкостной хроматографии с тандемной масс-спектрометрией (ЖХ-МС) возникают матричные эффекты. Стоит напомнить коллегам, что достижение быстрого, дешевого и полного результата требует огромных ресурсов, но они могут лишь сказать, что у них «не так много времени на проведение исследования».
Тем не менее, в зависимости от аналитических целей исследования, существуют методы, которые при правильной оптимизации, позволят найти тот самый «Святой Грааль» недорого и быстро. Чтобы эффективно их внедрять и использовать, нужно знать предпосылки, на которых эти методы базируются. Данная работа содержит описание принципов оптимизации, возможно, самого простого из всех методов экстракции – жидкостно-жидкостной экстракции (liquid–liquid extraction, LLE), также известного как разделение растворителем.
Независимо от того, какую «версию» LLE предполагается использовать, все они имеют общие понятия, важнейшим из которых, возможно, является информация про физико-химические свойства анализируемого вещества. Известно, что для нейтральных молекул коэффициент разделения воды и органического растворителя напрямую связан с кислотностью водородной связи аналита, основно́стью водородной связи, биполярностью, поляризуемостью и молярным объемом. Для ионизируемых образцов требуется, по крайней мере, еще один дескриптор, связанный со свойствами ионной формы. Однако опыт некоторых исследователей указывает на то, что такого рода предположения редко используются на практике – обычно применяется метод проб и ошибок в сочетании с различными комбинациями растворителей.
Понимание физико‑химических параметров аналита
Для достижения максимальной селективности и извлечения необходимо обеспечить максимально эффективное разделение целевых аналитов при их переходе из одной фазы в другую, что в большинстве случаев подкрепляется некоторой простой физико-химической информацией, в частности:
- коэффициент разделения LogP(D) (существенно);
- константа диссоциации кислоты pKa (требуется для ионизируемых соединений);
- количество доноров или акцепторов водородных связей (полезно);
- удельный объем (обратный плотности) (м3/кг) (полезно).
Например, вот данные для молекулы катинона, которая является ионогенным веществом, как показано на рисунке 1:
- LogD (pH10) = 1,18
- LogD (pH2) = -1,86
- pKa = 7,55
- Число доноров водородной связи 1
- Удельный объем 0,91
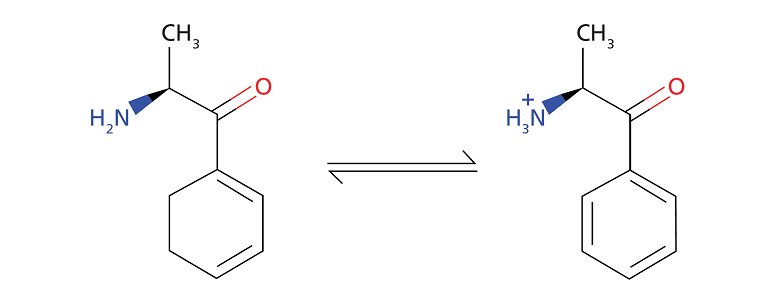
Рисунок 1. Динамическое равновесие целевого аналита катинона
Эта информация доступна в различных источниках, среди которых при подготовке данной публикации широко использовались следующие:
- Chemspider (Королевское химическое общество, Великобритания);
- Chemicalize (венгерской компании ChemAxon);
- База данных UFZ-LSER;
- MarvinSketch (венгерской компании ChemAxon, в частности, позволил вычислить значения для аналитов, которых не было в предыдущих базах данных).
Как эту информацию можно использовать для разработки и оптимизации исследования методом жидкостно-жидкостной экстракции? Первым действием при проектировании любой жидкостной экстракции является выбор экстрагирующего растворителя, что обусловлено относительной гидрофобностью молекулы аналита, которую отражает его значение logP(D).
В качестве краткого напоминания, поведение разделения аналита между двумя фазами будет отражаться в значениях logP (таблица 1).
Таблица 1. Распределение фаз аналита при различных значениях logP
| Значение logP аналита | Соотношение органический растворитель : вода |
| 10 | 100:1 |
| 1 | 10:1 |
| 0 | 1:1 |
| -1 | 1:10 |
| -10 | 1:100 |
Как видно из таблицы 1, значение logP аналита будет указывать на степень извлечения аналита из водной матрицы.
Манипуляции с рН аналита
Физико-химические данные катинона указывают на то, что значение logP(D) будет варьироваться в зависимости от значения рН раствора образца. Эта информация может использоваться при подготовке исследования методом жидкостно-жидкостной экстракции. В данном случае повышение значения водного рН катиона позволит сделать аналит нейтральным и поместить его слева от точки равновесия. При этом, значение LogD аналита (поскольку аналит ионизируется, мы использовали LogD, а не logP, но общие соотношения сохраняются) составит 1,18 и разделит образец на органическую фазу в пропорции 10:1 в зависимости от выбранного органического растворителя.
Рисунок 2 указывает соотношение значений рН и pK раствора и целевые значения рН.
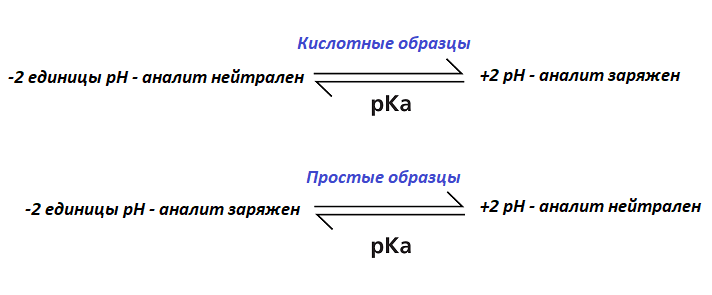
Рисунок 2. Cоотношение значений рН и pK раствора
Рост значения рН раствора образца до 9,55 или выше в целевом катиноновом аналите обеспечит его нейтральность, а значение LogD будет равно 1,18. Это позволит ему более успешно экстрагироваться из водного образца в органический растворитель. Это указывает на важность знания физико-химических свойств аналита при подготовке экстракции. В случае, если раствор образца имел бы нейтральный или кислотный рН, коэффициент разделения анализируемого вещества был бы намного ниже, и степень его извлечения из раствора образца в экстрагирующий растворитель, соответственно, тоже.
В случае, если определить значение pKa и точную структуру аналита затруднительно, оценить влияние рН на эффективность экстракции растворителем можно с помощью следующих предполагаемых значений:
- рН 9 и 11 для предполагаемых основных аналитов;
- рН 6 и 7,5 для предполагаемых нейтральных аналитов;
- рН 2,5 и 4 для предполагаемых кислых аналитов.
Разница в извлечении аналита между каждой из пар значений рН иногда может быть довольно поразительной, и эти различия обусловлены неизвестным pKa аналита.
Обратная экстракция
Селективность экстракции, в ходе которой изменялось значение рН образца, может быть улучшена с помощью метода, известного как обратная экстракция. Когда целевые аналиты находятся в органической фазе, они могут быть повторно экстрагированы в водную фазу, значение рН которой было изменено. Это может гарантировать, что аналиты находятся в заряженной форме и, следовательно, максимально гидрофильны. Значение рН экстрагирующего раствора, полученного в ходе обратной экстракции, может быть изменено до основного – для кислых целевых аналитов, и наоборот – для основных целевых аналитов.
Таким образом, поскольку все нейтральные экстрагенты остаются в органическом растворителе, число случаев совместного элюирования и матричный фон (а, следовательно, и пределы обнаружения) снижаются – эффективность экстракции растет.
Ограничений числа возможных обратных экстракций для повышения специфичности исследования нет. Следовательно, значение рН водного слоя может быть снова изменено, чтобы гарантировать, что аналит находится в нейтральной форме и экстрагируется в органический растворитель. При этом, абсолютная концентрация аналита на каждой стадии обратной экстракции будет снижаться в соответствии с удельной степенью разделения, достигнутой на каждой стадии.
Использование солей
Экстракция более высокогидрофильных аналитов из водных проб может быть ускорена за счет добавления в исследуемый образец солей. Тут можно выделить два общих подхода:
Если значение рН раствора образца будет изменено так, чтобы обеспечить полную ионизацию аналита, ионно-ассоциированная соль с противоположным по отношению к аналиту зарядом будет делать его нейтральным. Судя по всему, такой нейтральный комплекс будет иметь гораздо более высокий коэффициент разделения, чем ионизированный аналит. Такой метод экстракции может быть использован, в случае, если аналиты кислые или основные.
Добавление простых солей в достаточно высоких концентрациях в водный раствор образца может существенно увеличить коэффициент разделения гидрофильных аналитов и улучшить экстракцию в органические экстракционные растворители. После добавления в раствор образца 3-5 М сульфата натрия растворимость аналита в нем снижается. Это приводит к переходу целевых аналитов в органическую фазу и росту эффективности экстракции. Существует множество солей, которые могут быть использованы таким образом. Необходимые их концентрации для достижения насыщения и оптимального извлечения аналита могут быть определены эмпирически.
Выбор экстракционного растворителя
Состояние целевых аналитов в ходе исследования методом жидкостно-жидкостной экстракции в значительной степени зависит от выбора органического растворителя, в который извлекается аналит. Различные растворители имеют разные полярности, и это влияет на их взаимодействие с аналитами. В Таблице 2 перечислены некоторые несмешивающиеся с водой растворители с указанием их индекса полярности.
Таблица 2. Значения индекса полярности популярных органических растворителей, которые используются при жидкостно-жидкостной экстракции.
| Растворитель | Индекс полярности |
| Пентан | 0,0 |
| Гептан | 0,1 |
| Толуол | 2,4 |
| Метил-трет-бутиловый эфир (МТБЭ) | 2,5 |
| Хлорбензол | 2,7 |
| Дихлорметан (ДХМ) | 3,1 |
| Бутанол-1 | 3,9 |
| Хлороформ | 4,1 |
| Этилацетат | 4,4 |
| Метилэтилкетон (МЕК) | 4,7 |
Более полярные аналиты (более низкие значения logP(D) также могут служить хорошим индикатором полярности) могут потребовать использования органического растворителя с более высоким значением индекса полярности, что будет способствовать оптимизации извлечения аналита из водной пробы в органический экстрагирующий растворитель. Правила при этом довольно просты – полярность аналита нужно сопоставить с полярностью экстракционного растворителя. В случае, если получить высокую степень полярности аналита невозможно, в качестве суррогата может использоваться образец с более низкими значениями logP.
Для дальнейшего повышения селективности в качестве экстракционного растворителя могут также использоваться «смешанные» органические системы. В этом случае исследователю потребуется выработать собственный оригинальный подход к экстракции с использованием смесей растворителей, которые доказали свою эффективность в конкретной области применения. Таблица 3 включает список смесей растворителей, которые могут оказаться особенно полезными. Для разделения смесей растворителей обычно используются 96-луночные лабораторные плашки. Это позволяет быстро оценить предполагаемый ход экстракции для большого количества анализируемых веществ, с различными растворителями и степенью рН.
Таблица 3. Применяемые смеси растворителей для более полного извлечения в процессе жидкостно-жидкостной экстракции.
| Комбинация растворителей | Соотношение растворителей |
| Этилацетат / МТБЭ | 1:1 |
| Ацетон / этилацетат / МТБЭ | 1:2:2 |
| ДХМ / МТБЭ / этилацетат | 1:2:2 |
| ДХМ / толуол / МТБЭ | 3:4:3 |
| МТБЭэ / толуол | 1:3, 1:1, 3:1 |
| Толуол / бутанол-1 | 1:3, 1:1, 3:1 |
| Бутанол МТБЭ | 1:3, 1:1, 3:1 |
Выбор наиболее эффективной комбинации растворителей зависит от природы анализируемого вещества и числа последовательно повторенных процессов экстракции.
Усовершенствованные методы выбора растворителей экстракции
Статья «Уравнения переноса нейтральных молекул и ионных частиц из воды в органические фазы», опубликованная в журнале The Journal of Organic Chemistry в 2010 году, описывает построение алгоритма прогнозирования эффективности экстракции, который основан на количественном соотношении значений logP(D) соединений в различных парах растворителей. Майкл Х. Абрахам и Уильям Э. Экри Мл. исследовали pKa, LogD, количество групп доноров водородных связей (HBD) и удельный объем аналита для расчета коэффициента его разделения в различных органических растворителях, используя уравнение, которое было получено из нескольких базовых измерений коэффициента разделения.
Существуют другие доступные онлайн инструменты для определения оптимального растворителя для жидкостно-жидкостной экстракции. Возможно, самый полезный из них – база данных UFZ-LSER. Применение системы SMILES для молекулы исследуемого катинона позволяет вычислить некоторые ключевые термодинамические и физико‑химические свойства молекулы, которые позже будут использоваться для прогнозирования коэффициентов разделения между широким спектром органических растворителей (смесей растворителей) и водой.
Это очень полезный инструмент для быстрого определения органических растворителей, который может быть использован в любых экспериментах. В данном конкретном примере было установлено, что хлороформ является оптимальным выбором для жидкостной экстракции катиона. База данных UFZ-LSER включает обширные сведения о соединениях с известными значениями и указывает надежные источники дескрипторов в сети, что также повышает надежность оценки коэффициента разделения. Однако ее применение менее эффективно в случае, когда необходимо вычислить свойства анализируемых веществ.
При выборе экстракционного растворителя всегда нужно помнить, каким слоем он выступает. Плотность некоторых органических растворителей выше, чем у воды, поэтому они будут занимать нижний слой в экстракционном сосуде. Вот некоторые из таких растворителей (в порядке возрастания плотности):
Хлорбензол (C6H5Cl) < 1,2-дихлорэтан (C2H4Cl2) < 1,2-дихлорбензол (C6H4Cl2) < дихлорметан (CH2Cl2) < трихлорэтилен (C2HCl3) < хлороформ (CHCl3) < тетрахлормета́н CCl4
Повышение селективности жидкостно-жидкостной экстракции
Выбор растворителя всегда влияет на специфичность экстракции, в частности, на возможность отделения целевых аналитов от компонентов матрицы, которые могут иметь сходные химические и физико-химические свойства. В случае, если для жидкостно-жидкостной экстракции используются простые бинарные системы растворителей, контроль специфичности ограничивается выбором органического растворителя, рН раствора образца и, возможно, ионной силой. С точки зрения селективности при выборе органического растворителя одним из важнейших является степень растворимости воды в органическом растворителе. Относительная растворимость воды в ряде органических растворителей приведена в таблице 4.
Таблица 4. Растворимость в воде популярных органических растворителей, которые используются при жидкостно-жидкостной экстракции
| Растворитель | Растворимость при температуре 20°C |
| Пентан | 0,009 |
| Гептан | 0,01 |
| Толуол | 0,033 |
| Метил-трет-бутиловый эфир (МТБЭ) | 1,5 |
| Хлорбензол | 0,04 |
| Дихлорметан (ДХМ) | 0,24 |
| Бутанол-1 | 20,1 |
| Хлороформ | 0,056 |
| Этилацетат | 3,3 |
| Метилэтилкетон (МЕК) | 10,0 |
Таблица 4 указывает на то, что некоторые органические растворители способны растворять соответствующий объем воды, поэтому можно ожидать, что они будут менее специфичны, чем те растворители, в которых вода демонстрирует гораздо более низкую растворимость. Использование растворителей, которые способны эффективнее растворять воду, приводит к получению экстрактов с более высоким содержанием интерферентов. Для поиска таких водорастворимых веществ можно воспользоваться данным ресурсом.
Зависимость экстракции от растворителя
С целью добиться максимального извлечения соотношение органического экстракционного растворителя к воде в образце должно быть высоким (возможно, даже выше, чем принято считать разумным). Оптимальным на наш взгляд может считаться соотношение 7:1, но фактическое оптимальное значение зависит от коэффициента разделения целевого аналита (аналитов) между двумя растворителями. База данных UFZ-LSER включает полезный инструмент Extraction tool, который позволяет оценить оптимальное соотношение растворитель/образец, что может значительно сэкономить время на эмпирическую оценку образца. Оптимальное значение для хлороформной экстракции катинона, которая описывалась выше, составляет 6:1, что указывает на то, что общее соотношение 7:1 близко к оптимальному.
Летучесть экстракционного растворителя и аналита
Летучесть экстрагирующего растворителя является еще одним важным фактором при выборе оптимального соотношения органический растворитель / вода. Время подготовки образца обычно ограничено временем, за которое объем органического растворителя может быть уменьшен путем испарения для достижения такой концентрации, которая соответствует аналитическим пределам обнаружения. Более летучие экстракционные растворители испаряются быстрее, что сокращает общее время эксперимента. При этом, быстрое испарение может повысить качественную и количественную погрешность измерения. Тщательный выбор растворителей с высоким сродством к целевым аналитам позволяет использовать меньшие объемы растворителя и, возможно, избежать необходимости его излишнего испарения.
Другим важным фактором, который часто упускают из виду, является летучесть аналита. Идеальный растворитель должен быть способен испаряться до высыхания за достаточно короткое время (10-15 мин) при нагревании до 30-40°С. Если аналит может выдержать эти условия без потерь или деградации, то коэффициент разделения будет высоким. Чем более летуч аналит в этих условиях, тем коэффициент разделения будет ниже. Если летучесть аналита существенно снижает данный показатель, необходимо рассмотреть возможность использования альтернативного экстракционного растворителя.
Режим смешивания и время экстракции
Простой процесс экстракции требует максимизации границы раздела между двумя фазами, что часто требует более интенсивного перемешивания образца. В современной лаборатории ручные встряхиваемые колбы должны заменяться на более мелкие сосуды, которые можно использовать с орбитальным шейкером или другими системами автоматизации. Необходимо также оптимизировать интенсивность смешивания образца, для максимального извлечения аналита за минимальный срок. Время экстракции также должно быть оптимизировано. Оно будет зависеть от режима смешивания, афинности (коэффициента распределения) экстрагирующего раствора для анализируемого вещества и соотношения пробы к экстрагирующему растворителю.
При подготовке простого эксперимента по жидкостно-жидкостной экстракции стоит учитывать гораздо больше факторов, чем может показаться на первый взгляд. Чтобы избежать стремления «получить что-то даром» и применять действительно быстрые, недорогие и эффективные протоколы экстракции требуются значительные усилия, в частности, по разработке собственных оригинальных исследовательских методик.


