Температура часто використовується для підвищення ефективності екстракції, особливо твердих зразків і летючих аналітів. Зараз для цього використовуються більш досконалі сучасні методи. Дана стаття являє собою огляд деяких з них.
Починаючи з самих ранніх етапів розвитку сучасного хімічного аналізу, наприклад, приладу для екстракції Сокслета, використання температури для підвищення ефективності екстракції триває досі, але за допомогою деяких нових методів. Занадто часто хіміки покладаються на емпіричне правило кінетики хімічних реакцій, яке говорить, що швидкість реакції подвоюється при зміні температури на 10°C. Проте, екстракція не є хімічною реакцією. Температура впливає на розчинність, дифузію, поверхневий натяг та інші властивості зразка, потенційно призводячи до розкладання розчиненої речовини. У даній статті ми досліджуємо вплив температури на процес екстракції.
Складно не погодитись з всесвітньо відомим підприємцем Біллом Гейтсом. Як і у випадку з засновником Microsoft, під час пандемії COVID-19 книгою, яка на мене вплинула, і яку я міг би порекомендувати, став «Діапазон. Чому універсали перемагають у спеціалізованому світі» (‘Range: How Generalists Triumph in a Specialized World’, 2019 рік, українською мовою не видавалась) журналіста-дослідника Девіда Епштейна.
Епштейн стверджує, що для особистого і професійного розвитку необхідні широта знань і досвіду, на відміну від гольфу, який вимагає систематичних тренувань (зокрема, м’язової пам’яті). Він стверджує, що новатори та «системні мислителі» розвивають «здатність поєднувати розрізнені частини інформації з багатьох різних джерел». Ця філософія знаходить свій відбиток в заклику Американського хімічного товариства (ACS) включити системне мислення в список цілей в галузі сталого розвитку ООН.
Коли мова йде про вирішення аналітичних завдань, гіперспеціалізація нашої сфери, поділ на мас-спектрометристів високої роздільної здатності, вібраційних спектроскопістів, гуру тонкошарової хроматографії та інших фахівців може завдати нам шкоди, оскільки аналітик повинен зрозуміти суть досліджуваної проблеми, знати відмінності зразка, який цікавлять його зараз, і тих, які використовувалися раніше, а також інструменти, доступні в аналітичному арсеналі для розв’язання проблеми. Фундаментальне знання наших методів і їх обмежень необхідно, щоб застосовувати їх самих належним чином.
Багато хто з наших методів екстракції використовуються для підвищення виходу екстракції. В ході екстракції Сокслета і її похідних прискорена екстракція розчинником (ASE), яку також називають екстракцією розчинником під тиском (PSE), мікрохвильова екстракція (MAE), ультразвукова екстракція (USAE) та інші пов’язані з ними методи використовують підвищені робочі температури для підвищення виходу і прискорення швидкості екстракції. Внаслідок підвищеної розчинності використання розчинника при цьому може значно знизитися в порівнянні з екстракцією при кімнатній температурі.
Для підвищення температури летючих аналітів, щоб перевести досліджувані з’єднання в газову фазу для подальшого уловлювання і аналізу, часто використовується продування з проміжним уловлюванням, або системи термодесорбції. Однак підвищена температура при екстракції – це не просто додавання спеки, а більше тепла (вищі температури) – не обов’язково краще. Слід побоюватися термічної деградації компонентів зразка. Важливо також відзначити, що, хоча кінетичний ефект підвищених температур присутній, сама екстракція в багатьох випадках залежить саме від термодинаміки.
Розчинність і поділ
В цілому підвищення температури збільшує розчинність твердих речовин в рідких розчинниках. Однак ступінь, з якою це відбувається, може сильно відрізнятися в залежності від самої речовини. Малюнок №1 демонструє різку зміну розчинності цукру і нітрату калію у воді в залежності від температури. Ступінь розчинності цукру при підвищенні температури на 40°С подвоюється. Для нітрату калію цей показник ще вище. З іншого боку, розчинність солі (хлорид натрію) практично не змінюється в широкому діапазоні температур, в той час, як для сульфату цезію (III) (Cs2(SO4)3) спостерігається зниження розчинності в міру того, як температура сполуки підіймається вище кімнатної.
Уявімо найбільш ймовірний сценарій, при якому досліджувана речовина являє собою суміш. У цій ситуації не можна бути впевненим у підвищенні виходу екстракції, оскільки зростання розчинності в залежності від температури відбувається не у всіх аналітів. На щастя, це надзвичайно рідкісний випадок роботи близько до меж розчинності хімічної системи.
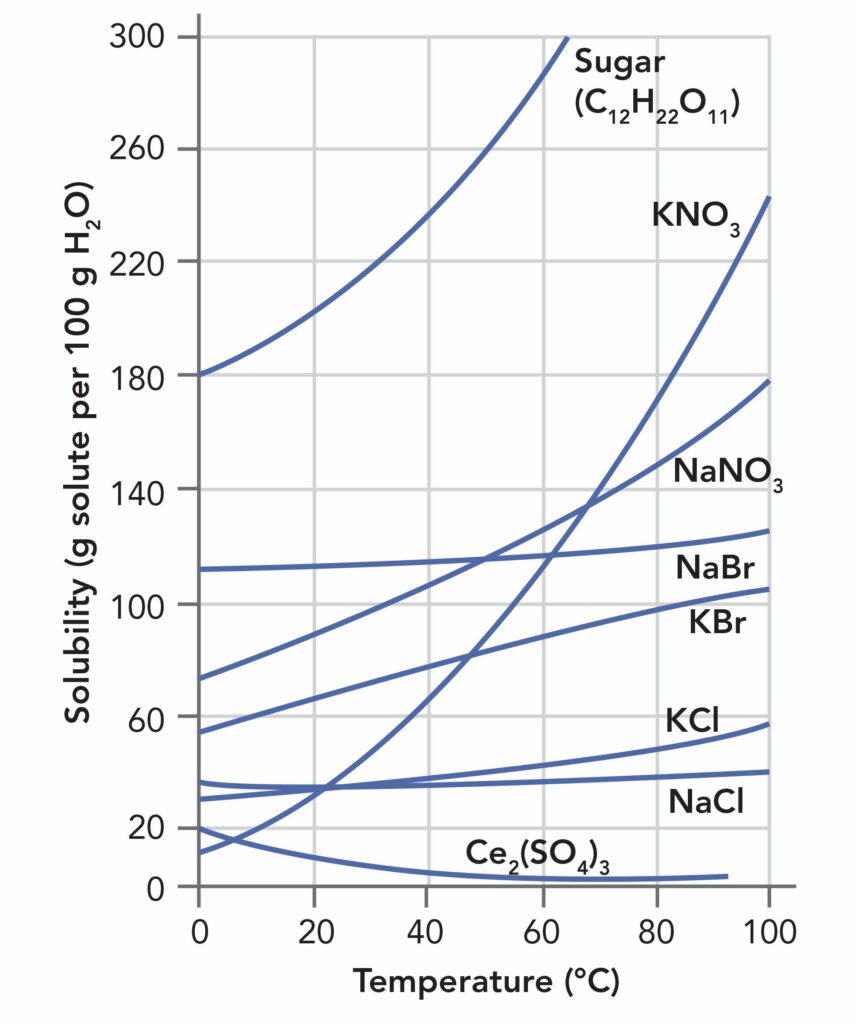
Малюнок №1. Розчинність цукру й окремих неорганічних солей в залежності від температури від 0 до 100°C.
Окремим випадком застосування підвищеної температури до рідких розчинників є так звана перегріта (субкритична) вода. При температурах вище 200°C і до критичної (374°C) діелектрична проникність води знижується до тих пір, поки вона не виявляється аналогічною деяким звичайним органічним розчинникам (варто звернути увагу, що для підтримки води в рідкому стані також застосовується підвищений тиск).
У цьому випадку доданої теплової енергії достатньо, щоб почати руйнування водневих зв’язків між молекулами води. При цьому «гаряча вода» починає процес солюбілізації неполярних розчинених речовин, які можуть бути повністю нерозчинними у звичайній рідкій воді. Це основа для «вилучення гарячої води», яка показала деякі перспективи в профільній літературі, але ще не була адаптована для широкого використання.
При надкритичній флюїдній екстракції (СКФ) ситуація ще складніша. Сольватирувальна здатність надкритичної рідини (надкритичного флюїду) безпосередньо пов’язана з її щільністю, яка є функцією як температури, так і тиску. В рамках даної екстракції тиск найлегше контролювати, тому температура утримується на потрібному рівні, а тиск використовується для регулювання густини (зміни розчинності), в разі, якщо під час екстракції потрібна селективність. При постійному тиску (поширена ситуація під час екстракції) зростання температури призводить до зниження густини і, отже, розчинності. Однак чіткий зв’язок між температурою, тиском і розчинністю відсутня.
Малюнок № 2 демонструє розчинність соєвої олії в надкритичному вуглекислому газі. До певної температури (в цьому випадку 60-70°C) розчинність тригліцеридів залишається досить низькою, після чого значно зростає. Деяку роль в цьому може грати фугасність розчиненої речовини. Існують численні рівняння стану для прогнозування щільності і відповідної їй розчинності. Для підвищення розчинності в надкритичних рідинах часто застосовується додавання невеликих обсягів (5-20%) органічного розчинника (модифікатора).
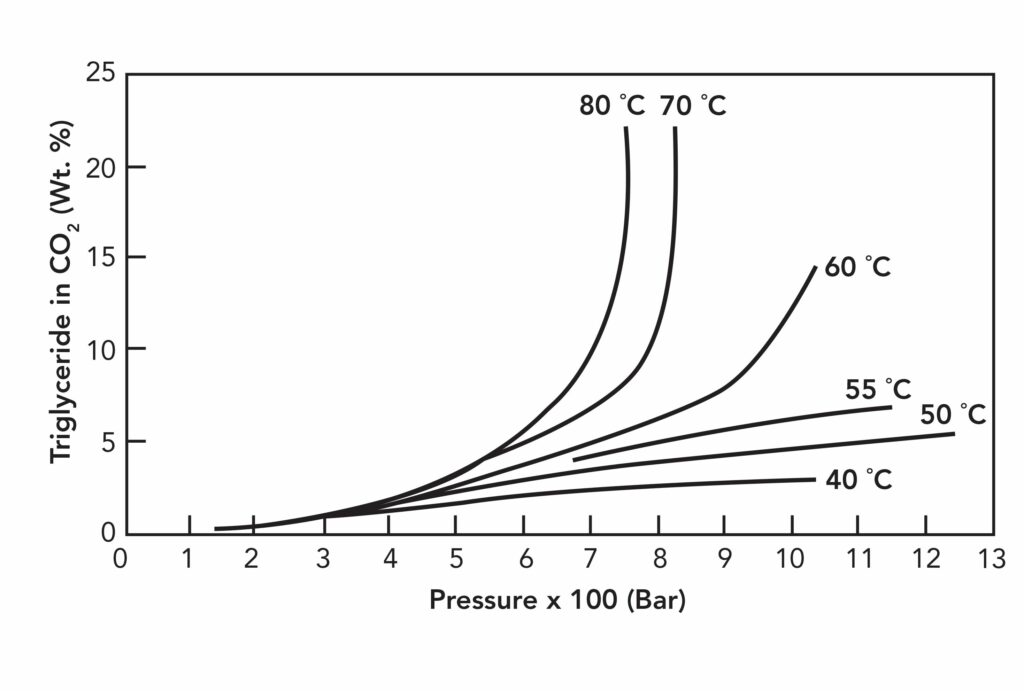
Малюнок №2. Розчинність соєвої олії в надкритичному вуглекислому газі в діапазоні температур 40-80°С при тиску до 1300 бар.
Для опису екстракції часто використовується термін «рівновага», хоча в багатьох (якщо не в більшості) випадків цей процес відбувається в умовах, далеких від рівноваги. Зазвичай для оцінки відносної розчинності речовин в екстракційних розчинниках використовується коефіцієнт розподілу н-октанол-вода Kow
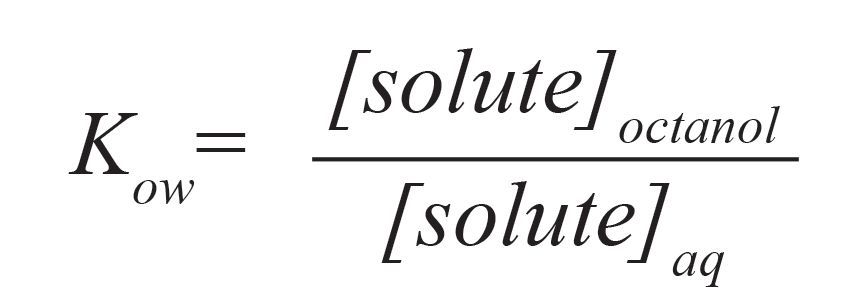
Малюнок №3. Коефіцієнт розподілу н-октанол-вода Kow.
Оскільки розчинність октанолу може, зокрема, імітувати поділ розчиненої речовини за допомогою неполярної ліпідної клітинної мембрани. З огляду на те, що розчинність речовини може значно варіюватися в залежності від її температури, оцінити зміни значення часто допомагає саме коефіцієнт kow. Для цього може використовуватися принцип Ле Шательє. Якщо процес розчинення екзотермічний (виділяє тепло), з ростом температури коефіцієнт поділу буде знижуватися. Для ендотермічних систем, в яких відбувається поглинання тепла, відповідні коефіцієнти поділу будуть збільшуватися. Ступінь зміни коефіцієнта поділу при цьому буде пропорційна ступеню зміни молярної тепломісткості розчину.
Волатильність
Як і розчинність, відносна волатильність може значною мірою змінюватися в залежності від температури й залежить від робочого тиску та обсягу компонентів зразка. Нагрівання збільшує швидкість випаровування, підсилює перенесення маси й переводить аналізовані речовини в газоподібний стан, збільшуючи їх концентрацію для подальшого збору. Проблема полягає в тому, що різні молекули мають різну волатильність і їх витягнуті обсяги розрізняються.
Малюнок № 4 демонструє вилучення ароматичних вуглеводнів за допомогою твердофазної мікроекстракції (SPME) з оливкової олії. Результати експерименту вказують, що при нагріванні зразка обсяг отриманих сполук змінюється хаотично. Ця результівна зміна в залежності від температури впливає на вихід екстракції окремих аналітів і потенційно може бути використана для виділення окремих компонентів зразка.
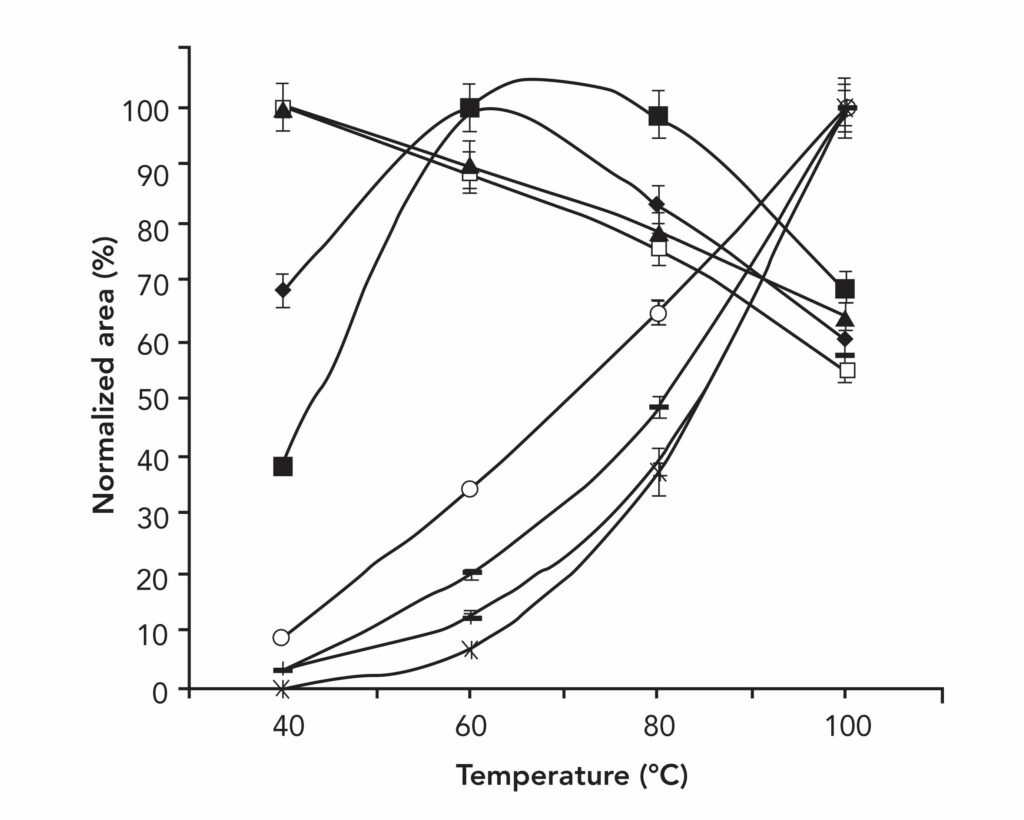
Малюнок № 4. 30-хвилинна екстракція методом SPME ароматичних вуглеводнів в оливковій олії в залежності від температури. С1-бензол, ( ▲ ) С2-бензол, ( • ) С3-бензол, ( ■ ) С4-бензол, ( ○ ) нафталін, ( _ ) аценаптен і аценафтілен, ( + ) фенантрен, антрацен і фтор, а також (x) флуорантен і пірен.
Термодинамічні параметри
Екстракцію можуть ускладнити не тільки низька розчинність, але і термодинаміка хімічної системи. Найбільш важливою, особливо при виділенні аналітів з твердих зразків, є роль дифузії розчиненої речовини через тверде тіло. Дифузія часто описується рівнянням Стокса-Ейнштейна, D = kT/6nna, де D – це коефіцієнт дифузії, k – постійна пропорційності, T – температура, η – в’язкість, а – активність. На перший погляд, існує пропорційна залежність між дифузією і температурою, що означає, що вищі температури прискорюють дифузію.
Дифузія, однак, також є характеристикою інших властивостей розчинника, зокрема, в’язкості й температури поверхні. Залежність в’язкості від температури описує рівняння Френкеля-Андраде: μ = AeB / T, де динамічна в’язкість пов’язана з температурою (T) через експоненціальну функцію, а константи A і B доступні в повних термодинамічних таблицях.
Відношення поверхневого натягу і температури являє собою ще складнішу функцію, яка включає критичну температуру розчинника, оскільки при критичній температурі поверхневий натяг знижується до нуля. Таким чином, зростання температури призводить до підвищення дифузії розчиненої речовини, прискоренню екстракції, але зв’язок зі швидкістю екстракції не обов’язково е лінійним.
Застосування надкритичних рідин дещо ускладнює ситуацію. Дифузія розчиненої речовини в надкритичних рідинах побічно пов’язана з густиною через в’язкість. Дифузійна здатність в цих рідинах знижується з ростом тиску при постійній температурі й збільшується з ростом температури при постійному тиску.
Кінетика або швидкість екстракції
Екстракція зазвичай слідує моделі швидкості першого порядку, аналогічної кінетиці хімічних реакцій. Однак цей процес відбувається шляхом поєднання розчинності та дифузії аналіту. Ні те, ні інше саме по собі не визначає швидкість реакції та, як ми переконалися, не обов’язково є лінійною функцією температури. Таким чином, хоча твердження щодо «подвоєння швидкості при кожній 10-градусній зміні температури» можуть мати сенс для оцінки кінетики реакції, це не належить екстракції.
Термічна деградація зразка
При нагріванні руйнування зразка (зазвичай шляхом окислення) викликає побоювання дослідників. Доброю аналітичною практикою є дотримання стандартів, які передбачають ретельний опис проб і їх перевірку на наявність продуктів розкладання. Чи існує проблема деградації образків при температурах, які використовуються при екстракції в ході сучасних досліджень?
Це було проблемою раніше для прискореної екстракції розчинником (ASE). Джон Еззел з Salt Lake Community College (США) вивчав цей метод на прикладі екстракції відомого генератора вільних радикалів дикумілпероксиду (C18H22O2). Його розрахунки періоду напіврозпаду вказували на те, що в ході екстракції тривалістю 7,5 хв при температурі 150°С очікується розкладання 30% зразка. Потім дикумілпероксид поміщали на пісок і екстрагували методом ASE з використанням гексану (C6H14) при температурах 100 і 150°С. Час нагрівання і екстракції становив 10 хвилин.
При нагріванні до 100°C деградації зразка не спостерігалося, так як була зафіксована екстракція 101% зразка з коефіцієнтом варіації (відносним стандартним відхиленням) 5,9%. При екстракції при температурі 150°С вихід екстракції знизився до 77%, що близько (в межах 75-80%) до розрахункового 30-вiдсотковому розкладанню. В обох випадках пляшка з розчинником перебувала під тиском і не дегазувалася. Коли гексан дегазувався і знаходився під тиском азоту, вихід екстракції при температурі 150°C збільшувався до 91% з коефіцієнтом варіації 0,83%, що вказує на те, що при дотриманні належних заходів безпеки термічного розкладання зразків у багатьох випадках можна уникнути.
Передбачається, що результати цього дослідження з дотриманням подібних запобіжних заходів можуть бути екстрапольовані на інші методи екстракції. Еззелл також зазначив, що деградація ненасичених жирних кислот при екстракції тригліцеридів з олійного насіння методом прискореної екстракції розчинником при температурі 130°C виявилася тією ж, яка спостерігалася при екстракції Сокслета.
Висновок
Використання підвищених температур сприяло розвитку сучасних методів екстракції. Разом з розчинністю в обраному екстрагувальному розчиннику і розміром частинок (для твердих зразків), температура нагрівання є одним з найважливіших параметрів, які визначають екстрагованість зразка і, меншою мірою, його селективність. Щоб максимально ефективно використовувати роль температури в ході екстракції, аналітик повинен поєднувати знання і досвід, відповідні типу зразка і застосовуваним методам екстракції.
Джерело: https://www.chromatographyonline.com/

