Температура часто используется для повышения эффективности экстракции, особенно твердых образцов и летучих аналитов. Сейчас для этого применяют более совершенные современные методы. Данная статья представляет собой обзор некоторых из них.
Начиная с самых ранних этапов развития современного химического анализа, например, прибора для экстракции Сокслета, использование температуры для повышения эффективности экстракции продолжается до сих пор, но с помощью некоторых новых методов. Слишком часто химики полагаются на эмпирическое правило кинетики химических реакций, которое гласит, что скорость реакции удваивается при изменении температуры на 10°C. Тем не менее, экстракция не является химической реакцией. Температура влияет на растворимость, диффузию, поверхностное натяжение и другие свойства образца, потенциально приводя к разложению растворенного вещества. В данной статье мы исследуем влияние температуры на процесс экстракции.
Кто я такой, чтобы не соглашаться с Биллом Гейтсом? Во время пандемии COVID-19 книгой, которая повлияла на автора этой статьи, и которую следует ппорекомендовать к прочтению, стала книга «Диапазон. Почему универсалы побеждают в специализированном мире» (‘Range: How Generalists Triumph in a Specialized World’, 2019 год, на русском языке не издавалась) журналиста-исследователя Дэвида Эпштейна.
Эпштейн утверждает, что для личного и профессионального развития необходимы широта знаний и опыта, в отличие от гольфа, который требует систематических тренировок (в частности, мышечной памяти). Он утверждает, что новаторы и «системные мыслители» развивают «способность соединять разрозненные части информации из многих различных источников». Эта философия находит свое отражение в призыве Американского химического общества (ACS) включить системное мышление в список Целей в области устойчивого развития ООН.
Когда речь идет о решении аналитических задач, аналитик должен понять суть изучаемой проблемы, знать отличия интересующих его сейчас и ранее используемых образцов, а также инструменты, доступные в аналитическом арсенале для решения проблемы. Фундаментальное знание наших методов и их ограничений необходимо, чтобы применять их самым надлежащим образом.
Многие из наших методов экстракции используют для повышения выхода экстракции. В ходе экстракции Сокслета и ее производных ускоренная экстракция растворителем (ASE), которую также называют экстракцией растворителем под давлением (PSE), микроволновая экстракция (MAE), ультразвуковая экстракция (USAE) и другие связанные с ними методы используют повышенные рабочие температуры для повышения выхода и увеличения скорости экстракции. Вследствие повышенной растворимости использование растворителя, при этом, может значительно снизиться по сравнению с экстракцией при комнатной температуре.
Для повышения температуры летучих аналитов, чтобы перевести исследуемые соединения в газовую фазу для последующего улавливания и анализа, часто используется продувка с промежуточным улавливанием, либо системы термодесорбции. Однако повышение температуры при экстракции – не обязательно увеличивает степень извлечения аналита. Следует опасаться термической деградации компонентов образца. Важно также отметить, что, хотя кинетический эффект повышенных температур присутствует, сама экстракция во многих случаях зависит именно от термодинамики.
Растворимость и разделение
В целом повышение температуры увеличивает растворимость твердых веществ в жидких растворителях. Однако степень, с которой это происходит, может сильно различаться в зависимости от самого вещества. Рисунок №1 демонстрирует резкое изменение растворимости сахара и нитрата калия в воде в зависимости от температуры. Степень растворимости сахара при повышении температуры на 40°С удваивается. Для нитрата калия этот показатель еще выше. С другой стороны, растворимость соли (хлорид натрия) практически не изменяется в широком диапазоне температур, в то время как для сульфата цезия (III) (Cs2(SO4)3) наблюдается снижение растворимости по мере того, как температура соединения поднимается выше комнатной.
Представим наиболее вероятный сценарий, при котором исследуемое вещество представляет собой смесь. В этой ситуации нельзя быть уверенным в повышении выхода экстракции, поскольку рост растворимости в зависимости от температуры происходит не у всех аналитов. К счастью, это чрезвычайно редкий случай работы близкой к пределам растворимости химической системы.
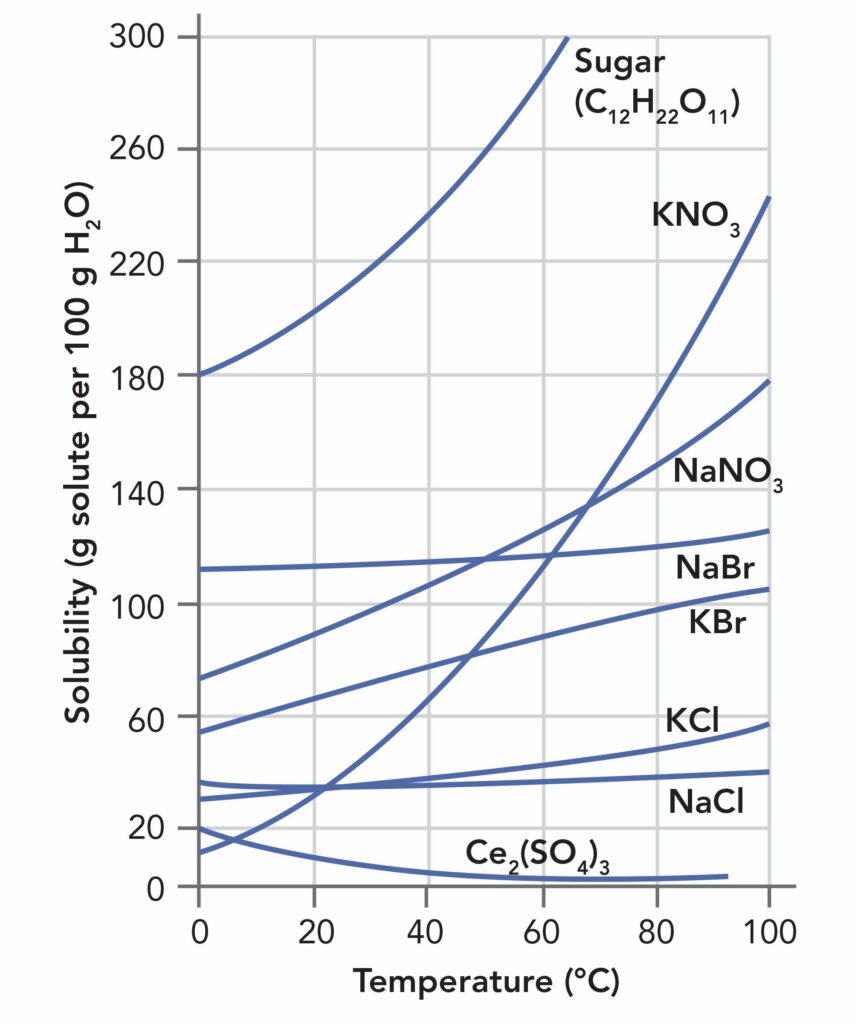
Рисунок №1. Растворимость сахара и отдельных неорганических солей в зависимости от температуры от 0 до 100°C.
Частным случаем применения повышенной температуры к жидким растворителям является так называемая перегретая (субкритическая) вода. При температурах выше 200°C и до критической (374°C) диэлектрическая проницаемость воды снижается до тех пор, пока она не оказывается аналогичной некоторым обычным органическим растворителям (стоит обратить внимание, что для поддержания воды в жидком состоянии также применяется повышенное давление).
В этом случае добавленной тепловой энергии достаточно, чтобы начать разрушение водородных связей между молекулами воды. При этом «горячая вода» начинает процесс солюбилизации неполярных растворенных веществ, которые могут быть полностью нерастворимыми в обычной жидкой воде. Это основа для «извлечения горячей воды», которая показала некоторые перспективы в профильной литературе, но еще не была адаптирована для широкого использования.
При сверхкритической флюидной экстракции (СКФ) ситуация еще сложнее. Сольватирующая способность сверхкритической жидкости (сверхкритического флюида) напрямую связана с ее плотностью, которая является функцией как температуры, так и давления. В рамках данной экстракции давление легче всего контролировать, поэтому температура удерживается на нужном уровне, а давление используется для регулировки плотности (изменения растворимости), в случае, если во время экстракции требуется селективность. При постоянном давлении (распространенная ситуация во время экстракции) рост температуры приводит к снижению плотности и, следовательно, растворимости. Однако четкая связь между температурой, давлением и растворимостью отсутствует.
Рисунок №2 демонстрирует растворимость соевого масла в сверхкритическом углекислом газе. До определенной температуры (в данном случае 60-70°C) растворимость триглицеридов остается достаточно низкой, после чего значительно возрастает. Некоторую роль в этом может играть фугасность растворенного вещества. Существуют многочисленные уравнения состояния для прогнозирования плотности и соответствующей ей растворимости. Для повышения растворимости в сверхкритических жидкостях часто применяется добавление небольших объемов (5-20%) органического сорастворителя (модификатора).
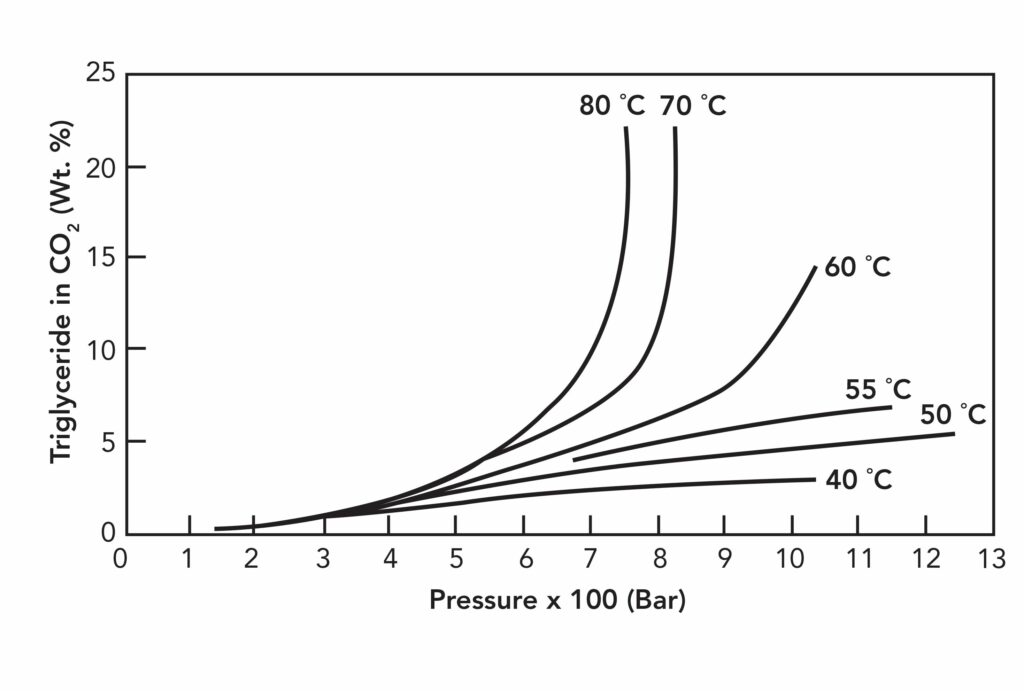
Рисунок №2. Растворимость соевого масла в сверхкритическом углекислом газе в диапазоне температур 40-80°С при давлении до 1300 бар.
Для описания экстракции часто используется термин «равновесие», хотя во многих (если не в большинстве) случаев этот процесс происходит в условиях, далеких от равновесия. Обычно для оценки относительной растворимости веществ в экстракционных растворителях используется коэффициент распределения н-октанол – вода Kow, поскольку растворимость октанола может, в частности, имитировать разделение растворенного вещества с помощью неполярной липидной клеточной мембраны.
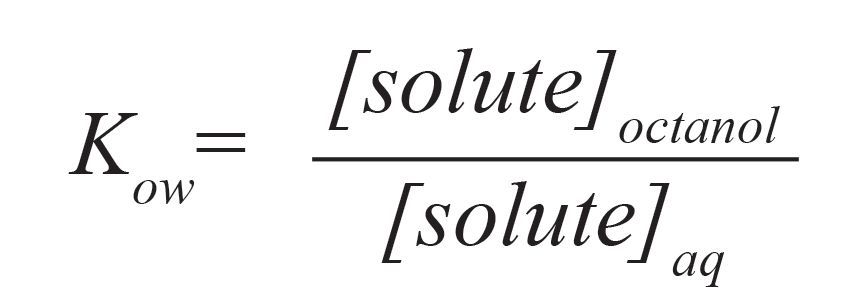
Рисунок №3. Коэффициент распределения н-октанол – вода Kow.
Учитывая, что растворимость вещества может значительно варьироваться в зависимости от его температуры, оценить изменения значения зачастую помогает именно коэффициент Kow. Для этого может использоваться принцип Ле Шателье. Если процесс растворения экзотермичен (выделяет тепло), с ростом температуры коэффициент разделения будет снижаться. Для эндотермических систем, в которых происходит поглощение тепла, соответствующие коэффициенты разделения будут увеличиваться. Степень изменения коэффициента разделения при этом будет пропорциональна степени изменения молярной теплоемкости раствора.
Волатильность
Как и растворимость, относительная волатильность может в значительной степени изменяться в зависимости от температуры и зависит от рабочего давления и объема компонентов образца. Нагревание увеличивает скорость испарения, усиливает перенос массы и переводит анализируемые вещества в газообразное состояние, увеличивая их концентрацию для последующего сбора. Проблема заключается в том, что разные молекулы обладают разной волатильностью и их извлеченные объемы различаются.
Рисунок №4 демонстрирует извлечение ароматических углеводородов с помощью твердофазной микроэкстракции (SPME) из оливкового масла. Результаты эксперимента указывают, что при нагревании образца объем полученных соединений изменяется хаотично. Это результирующее изменение в зависимости от температуры влияет на выход экстракции отдельных аналитов и потенциально может быть использовано для выделения отдельных компонентов образца.
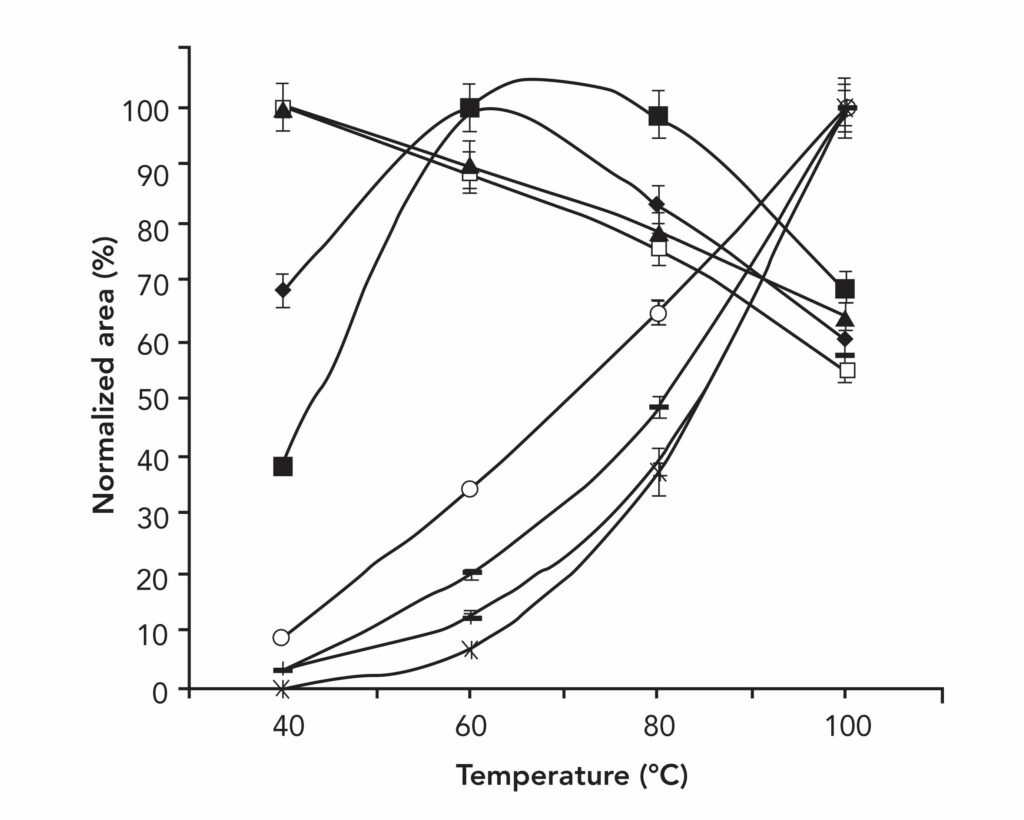
Рисунок №4. 30-минутная экстракция методом SPME ароматических углеводородов в оливковом масле в зависимости от температуры; конретные стандарты вклюают в себя: С1-бензол, (▲) С2-бензол, (•) С3-бензол, (■) С4-бензол, (○) нафталин, (_) аценаптен и аценафтилен, (+) фенантрен, антрацен и фтор, а также (×) флуорантен и пирен.
Термодинамические параметры
Экстракцию могут затруднить не только низкая растворимость, но и термодинамика химической системы. Наиболее важной, особенно при выделении аналитов из твердых образцов, является роль диффузии растворенного вещества через твердое тело. Диффузия часто описывается уравнением Стокса-Эйнштейна, D = kT/6πηa, где D – это коэффициент диффузии, k – коэффициент пропорциональности, T – температура, η – вязкость, а – активность. На первый взгляд, существует пропорциональная зависимость между диффузией и температурой, что означает, что более высокие температуры ускоряют диффузию.
Диффузия, однако, также является характеристикой других свойств растворителя, в частности, вязкости и температуры поверхности. Зависимость вязкости от температуры описывает уравнение Френкеля-Андраде: μ = AeB/T, где динамическая вязкость связана с температурой (T) через экспоненциальную функцию, а константы A и B доступны в полных термодинамических таблицах.
Отношение поверхностного натяжения и температуры представляет собой еще более сложную функцию, которая включает критическую температуру растворителя, поскольку при критической температуре поверхностное натяжение снижается до нуля. Таким образом, рост температуры приводит к повышению диффузии растворенного вещества, ускорению экстракции, но связь со скоростью экстракции не обязательно линейна.
Применение сверхкритических жидкостей несколько затрудняет ситуацию. Диффузия растворенного вещества в сверхкритических жидкостях косвенно связана с плотностью через вязкость. Диффузионная способность в этих жидкостях снижается с ростом давления при постоянной температуре и увеличивается с ростом температуры при постоянном давлении.
Кинетика или скорость экстракции
Экстракция обычно следует модели скорости первого порядка, аналогичной кинетике химических реакций. Однако этот процесс происходит за счет сочетания растворимости и диффузии аналита. Ни то, ни другое само по себе не определяет скорость реакции и, как мы убедились, не обязательно является линейной функцией температуры. Таким образом, хотя утверждения насчет «удвоения скорости при каждом десятиградусном изменении температуры» могут иметь смысл для оценки кинетики реакции, это не относится к экстракции.
Термическая деградация образца
Каждый раз, когда мы нагреваем образец, возникает проблема разрушения, обычно в результате окисления. Хорошей аналитической практикой является следование стандартам, которые подразумевают тщательное описание проб и их проверку на наличие продуктов разложения. Обостряется ли проблема деградации при температурах, используемых в современных методиках аналитической экстракции? Это было проблемой на раннем этапе разработки ускоренной экстракции растворителями (ASE). Джон Эззел из Salt Lake Community College (США) изучал этот метод на примере экстракции известного генератора свободных радикалов дикумилпероксида (C18H22O2). Его расчеты периода полураспада указывали на то, что в ходе экстракции длительностью 7,5 минут при температуре 150°С ожидается разложение 30% образца. Затем дикумилпероксид помещали на песок и экстрагировали методом ASE с использованием гексана (C6H14) при температурах 100 и 150°С. Время нагрева и экстракции составляло 10 минут.
При нагревании до 100°C деградации образца не наблюдалось, так как была зафиксирована экстракция 101% образца с коэффициентом вариации (относительным стандартным отклонением) 5,9%. При экстракции при температуре 150°С выход экстракции снизился до 77%, что близко (в пределах 75-80%) к расчетному 30процентному разложению. В обоих случаях бутылка с растворителем находилась под давлением и не дегазировалась. Когда гексан дегазировался и находился под давлением азота, выход экстракции при температуре 150°C увеличивался до 91% с коэффициентом вариации 0,83%, что указывает на то, что при соблюдении надлежащих мер безопасности термического разложения образцов во многих случаях можно избежать.
Предполагается, что результаты этого исследования с соблюдением подобных мер предосторожности могут быть экстраполированы на другие методы экстракции. Эззелл также отметил, что деградация ненасыщенных жирных кислот при экстракции триглицеридов из масличных семян методом ускоренной экстракции растворителем при температуре 130°C оказалась той же, которая наблюдалась при экстракции Сокслета.
Выводы
Использование повышенных температур способствовало развитию современных методов экстракции. Вместе с растворимостью в выбранном экстрагирующем растворителе и размером частиц (для твердых образцов), температура нагревания является одним из самых важных параметров, которые определяют экстрагируемость образца и, в меньшей степени, его селективность. Чтобы максимально эффективно использовать роль температуры в ходе экстракции, аналитик должен сочетать знания и опыт, соответствующие типу образца и применяемым методам экстракции.
Источник: https://www.chromatographyonline.com/

