У 1992 році Тасуку Хонджо відкрив один із ключових білків імунної системи, а у 2018 році отримав за нього Нобелівську премію. Цей білок – і терапія, заснована на взаємодії із ним – виявилася вражаюче ефективною в боротьбі з раком. Мова йде про PD-1. PD-1 (Programmed Cell Death Protein 1) – це білок програмованої клітинної смерті, який в нормі експресується на поверхні Т-клітин та В-клітин, а також на поверхні природніх кілерів (NK), моноцитів та деяких дендритних клітинах. Його роль полягає у гальмуванні відповіді клітин імунної системи на власні клітини організму, які несуть на своїй поверхні його ліганд (PD-L1 – Programmed Cell Death Ligand 1).
PD-1/PD-L1 система є одним із механізмів “імунних контрольних точок” (immune checkpoints), що захищає наш організм від надмірної активації Т-лімфоцитів та розвитку аутоімунних реакцій. Зв’язування PD-1 з його лігандом PD-L1 призводить до інгібування проліферації Т-клітин, зниження секреції цитокінів та, зрештою, до апоптозу антиген-специфічних Т-клітин. В нашому організмі значна кількість клітин мають PD-L1 – клітини імунної системи, мезенхімальні стовбурові клітини, клітини кісткового мозку, легень, печінки, підшлункової, плаценти, шкіри, нервової системи, тощо. Однак, що дуже важливо – PD-L1 також може експресуватись на поверхні пухлинних клітин. Власне, критична важливість PD-1/PD-L1 системи в онкології саме і полягає в тому, що пухлинні клітини використовують цей фізіологічний механізм для власного захисту.
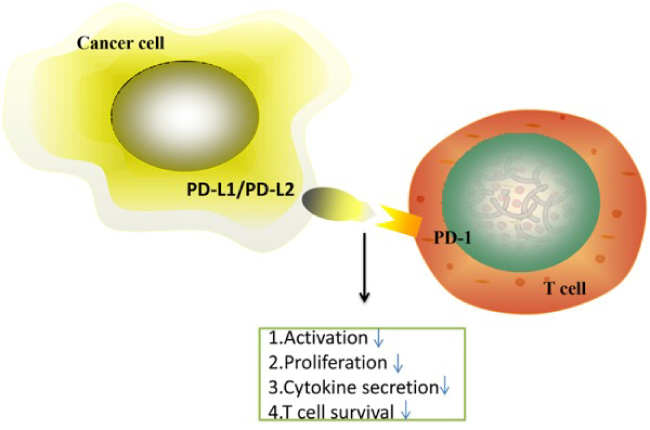
Han, Y., Liu, D., & Li, L. (2020). PD-1/PD-L1 pathway: current researches in cancer. American journal of cancer research, 10(3), 727–742.
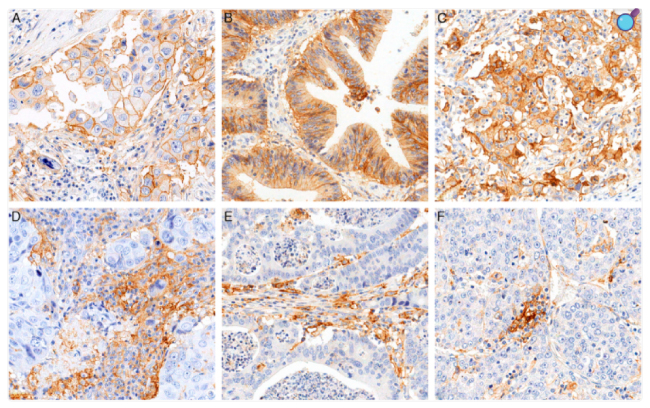
Пухлини різних типів, зокрема рак легені, меланома, рак голови та шиї, нирково-клітинна карцинома та інші, часто надекспресують PD-L1 на своїй поверхні. Подібне явище називають “адаптивним імунним механізмом”. Т- та NK-клітини секретують інтерферон-гамма (IFN-γ), який індукує експресію PD-L1 на поверхні клітин-мішеней, в тому числі і на пухлинних клітинах. Таким чином, PD-L1 діє як протуморогенний фактор у клітинах раку шляхом зв’язування зі своїми рецепторами та активації проліферативних та сигнальних шляхів виживання. Крім того, PD-L1 бере участь і у подальшому прогресуванні пухлини. Зокрема, PD-L1 має неімунні проліферативні ефекти на різні типи пухлинних клітин: наприклад, у клітина раку нирок індукує епітеліально-мезенхімальний перехід (ЕМП) та фенотипи, подібні до стовбурових клітин. Більше того, внутрішньоклітинні сигнальні шляхи, такі як PI3K/AKT, MAPK та JAK/STAT, також залучені до регуляції експресії PD-L1, що робить цей процес багатофакторним і залежним від молекулярного контексту конкретної пухлини.