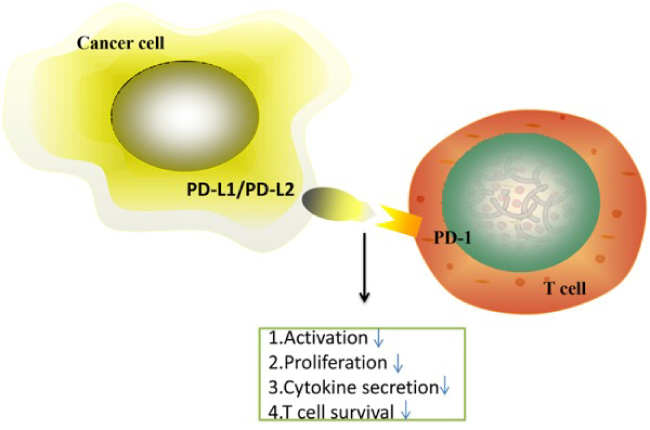
В 1992 году Тасуку Хонджо открыл один из ключевых белков иммунной системы, а в 2018 году получил за него Нобелевскую премию. Этот белок – и терапия, основанная на взаимодействии с ним – оказалась поразительно эффективной в борьбе с раком. Речь идет о PD-1. PD-1 (Programmed Cell Death Protein 1) – это белок программируемой клеточной смерти, который в норме экспрессируется на поверхности Т-клеток и В-клеток, а также на поверхности естественных киллеров (NK), моноцитов и некоторых дендритных клетках. Его роль заключается в торможении ответа клеток иммунной системы на собственные клетки организма, которые несут на своей поверхности его лиганд (PD-L1 – Programmed Cell Death Ligand 1).
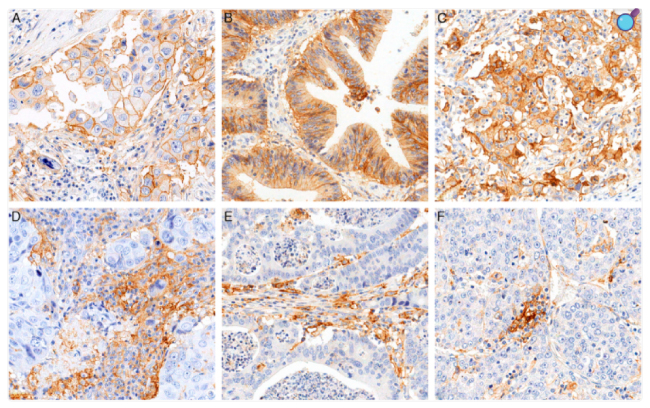
Система PD-1/PD-L1 является одним из механизмов «иммунных контрольных точек» (immune checkpoints), защищающих наш организм от чрезмерной активации Т-лимфоцитов и развития аутоиммунных реакций. Связывание PD-1 с его лигандом PD-L1 приводит к ингибированию пролиферации Т-клеток, снижению секреции цитокинов и, в конечном итоге, к апоптозу антиген-специфических Т-клеток. В нашем организме значительное количество клеток имеют PD-L1 – клетки иммунной системы, мезенхимальные стволовые клетки, клетки костного мозга, легких, печени, поджелудочной железы, плаценты, кожи, нервной системы и т.д. Однако, что очень важно – PD-L1 также может экспрессироваться на поверхности опухолевых клеток. Собственно, критическая важность PD-1/PD-L1 системы в онкологии именно и заключается в том, что опухолевые клетки используют этот физиологический механизм для собственной защиты.
Han, Y., Liu, D., & Li, L. (2020). PD-1/PD-L1 pathway: current researches in cancer. American journal of cancer research, 10(3), 727–742.
Опухоли различных типов, в частности рак легких, меланома, рак головы и шеи, почечно-клеточная карцинома и другие, часто переэкспрессируют PD-L1 на своей поверхности. Подобное явление называют «адаптивным иммунным механизмом». Т- и NK-клетки секретируют интерферон-гамма (IFN-γ), который индуцирует экспрессию PD-L1 на поверхности клеток-мишеней, в том числе и на опухолевых клетках. Таким образом, PD-L1 действует как протуморогенный фактор в клетках рака путем связывания со своими рецепторами и активации пролиферативных и сигнальных путей выживания. Кроме того, PD-L1 участвует и в дальнейшем прогрессировании опухоли. В частности, PD-L1 обладает неиммунными пролиферативными эффектами на различные типы опухолевых клеток: например, в клетках рака почек индуцирует эпителиально-мезенхимальный переход (ЭМП) и фенотипы, сходные со стволовыми клетками. Более того, внутриклеточные сигнальные пути, такие как PI3K/AKT, MAPK и JAK/STAT, также вовлечены в регуляцию экспрессии PD-L1, что делает этот процесс многофакторным и зависимым от молекулярного контекста конкретной опухоли.