Лабораторное сопровождение трансплантации является неотъемлемой частью этого процесса. Применение адекватных современных и валидированных рутинных технологий обеспечивает успех трансплантации органов, более продолжительную полноценную жизнь как графта/гемопоэтических клеток, так и, собственно, пациента, уменьшает стоимость и продолжительность посттрансплантационного лабораторного мониторинга и медицинского сопровождения пациента после проведения трансплантации.
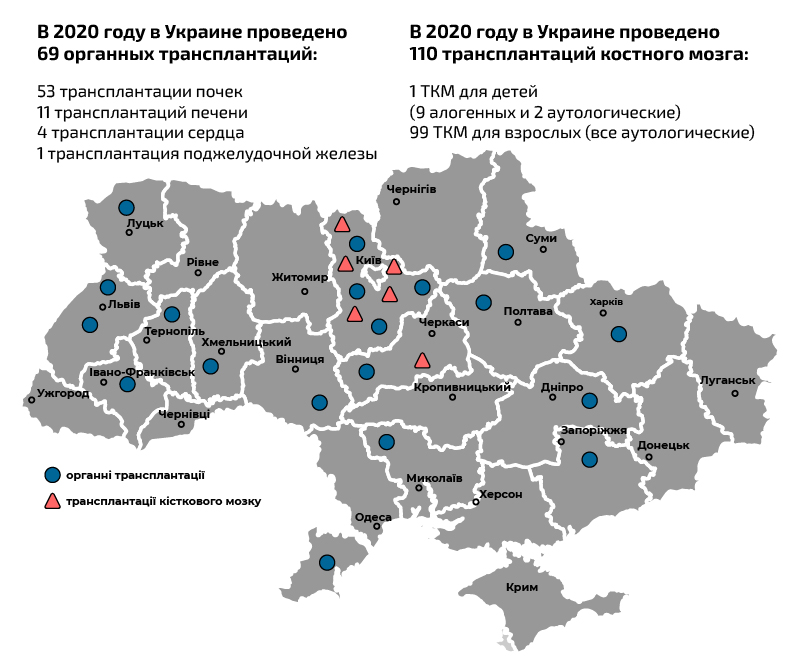
трансплантации в Украине в 2020 году
При подборе пары донор-реципиент, а также для создания донорских реестров возникает задача проведения HLA-типирования как первого этапа порядка поиска совместимого донора в рутинной трансплантации (*порядок поиска и протокол может отличаться в случае ургентной трансплантации – см. соответствующие приказы Минздрава):
- Молекулярно-генетическое HLA-типирование донора и реципиента методологическим подходом соответствующего разрешения – наилучшим результатом поиска совместимого донора является совпадение HLA-гаплотипа донора и реципиента на уровне 10/10 среднего и высокого разрешения в соответствии с номенклатурой HLA (Международная база данных IMGT/HLA Database //www.ebi.ac.uk/ipd/imgt/hla/). Современная HLA-номенклатура представлена на веб-ресурсе Международной ассоциации иммуногенетики (www.hla.alleles.org/nomenclature), где предоставлена информация о количестве открытых аллелей каждого HLA-локуса, перечне всех генов HLA и их молекулярная характеристика, изменения и дополнения к номенклатуре .
- Получение ответа на запрос о наличии гистосовместимого донора в базе данных Реестра.
- Проведение сравнения соответствующих антигенов HLA-донора и реципиента. По результатам отбирается донор с полностью совместимым или частично совместимым (в некоторых случаях) с пациентом набором аллелей.
- Ответ на поисковый запрос в установленной форме и в необходимый срок.
- В случае совпадения генотипов потенциального донора и реципиента направляется запрос на активацию донора, подписание информированного согласия на донацию.
- После проведения необходимых информационных и инфекционных мероприятий лабораторное сопровождение расширяется соответствующими лабораторными тестированиями, а именно иммунологическими (определение предсуществующих HLA-связанных антител) и серологических (кросс-матч) методов типирования.
Серологические методы HLA-типирования
Серологические методы основаны на идентификации молекул МНС, экспрессированных на мембране, посредством специфических антител. На практике серологическое типирование является последним этапом (!!!!) и проводится на выделенных клеточных популяциях. Поскольку основными носителями антигенов МНС являются лимфоциты, суспензию Т-лимфоцитов используют для определения антигенов класса I, а суспензию В-лимфоцитов – для определения антигенов класса II гистосовместимости. Наиболее распространенным методом типирования HLA-антигенов является лимфоцитотоксический тест «кросс-матч», модифицированный Полем Терасаки и в последнее время, благодаря развитию методологий, проводится двумя лабораторными подходами:
- классическим CDC – в плашках Терасаки с применением инвертированного микроскопа для анализа
- протоковой цитометрией (более современный подход) – сам тест производится на проточном цитометре и анализируется программным обеспечением прибора с последующей возможностью проводить виртуальный кросс-матч.
Стандартный лимфоцитотоксический кросс-матч в плашках Терасаки с применением инвертированной микроскопии для анализа
Принцип лимфоцитотоксического теста (кросс-матч) основан на способности специфических антител взаимодействовать с HLA-антигенами соответствующей специфичности антител, образуя комплекс «антиген-антитело». Связывание комплемента с комплексом антиген-антитело запускает каскад реакций, что приводит к повреждению клеточной мембраны и лизису клеток. При отрицательной реакции лимфоциты остаются невредимыми. При положительной реакции лимфоциты разрушаются. Визуализация положительной реакции производится с помощью суправитальных красителей (эозин, трипановый синий) или на более современном уровне с помощью флуоресцентных красителей. Определение фенотипа HLA – осуществляется по совокупности положительных и отрицательных реакций.
Для кросс-матч используются моноклональные антитела или панель диагностических сывороток с широким спектром антител к HLA-антигенам различных специфичностей. Диагностические сыворотки с HLA-антигенами получаются от иммунизированных доноров. Иммунизация может быть вызвана беременностью (у 10-20% беременных производятся антитела к родительским HLA-антигенам HLA гаплотипа плода), переливанием крови или трансплантацией органов. Направленная иммунизация доноров пересадкой кожи, переливанием крови или лейкоцитарной массы приводит к появлению высокоактивных антител к HLA-антигенам.
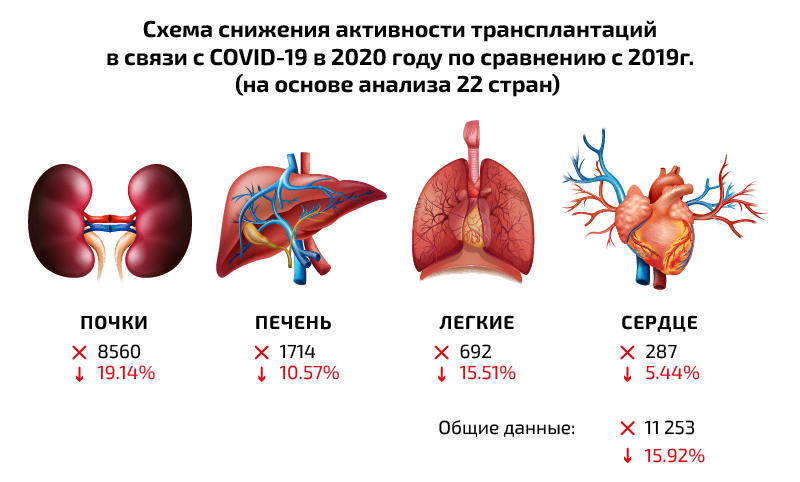
Схема снижения активности трансплантаций в связи с COVID
Протоколы выделения Т и В лимфоцитов для дальнейшего проведения серологического кросс-матча
А) Выделение HLA класс I и класс II антиген-экспрессирующих клеток из цельной крови с помощью магнитных частиц Dynabeads™ HLA CLASS I и/или CLASS II (21001D, 21002D, 21003, 21004D) на магнитном штативе
Реагенты и оборудование:
- Dynabeads ™ HLA Класс I содержит 1,4 × 108 бидсов/мл – 2 мл (20 выделений)
- Dynabeads™ HLA Класс II содержит 2,8 × 108 бидсов/мл – 2 мл (20 выделений)
- PBS, pH 7.4, с цитратом натрия (добавить 0.6% v/v цитрата натрия)
- PBS, pH 7.4
- Среда RPMI*
- FBS heat-inactivated (инактивировать 60 мин при 56°C на водяной бане)
- DynaMag магнит/Easysep магнит
- Смеситель позволяет наклонять и вращать пробирки
- Пробирки для сбора крови, содержащие антикоагулянт (ACD, гепарин натрия)
- Пробирки 5 и 15 мл
- 5 мл пипетки
- Контейнер для слива
- Охлаждающее устройство
Пошаговая процедура:
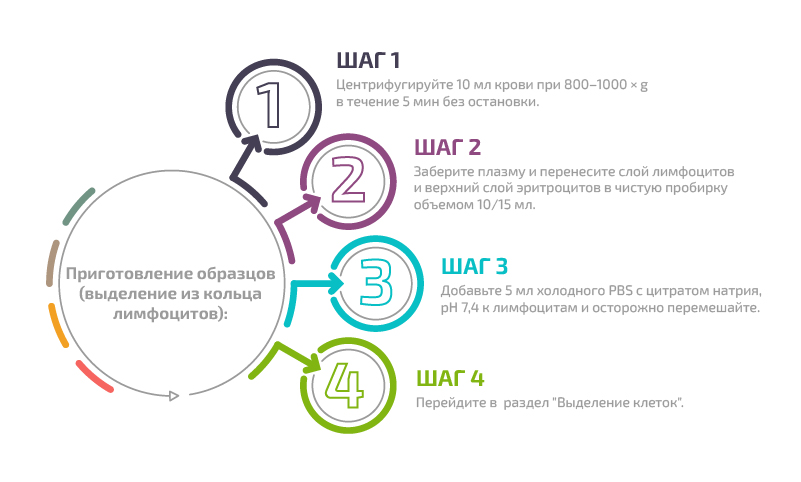
Приготовление образцов (выделение из кольца лимфоцитов)
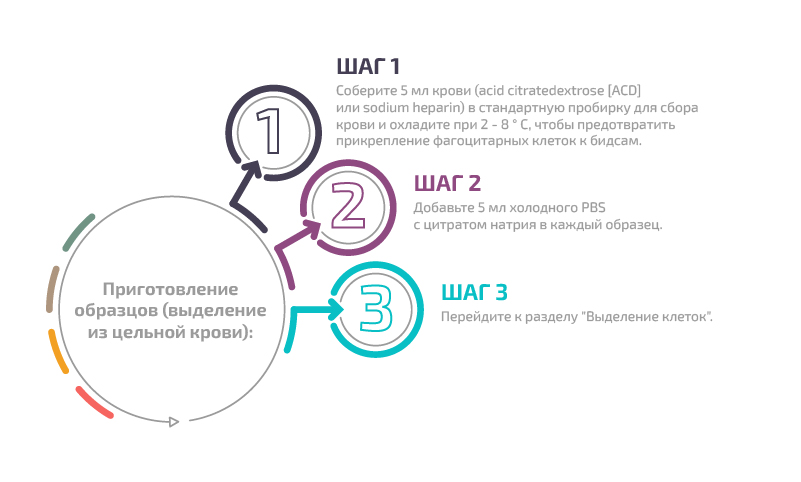
Приготовление образцов (выделение из цельной крови)

Выделение клеток
Б) Выделение Т лимфоцитов с помощью специфического реагента FluoroBeads®-Т
Реагенты и оборудование:
- Набор FluoroBeads®-Т
- FluoroBeads®-T Developer (10X)
- Phosphate Buffered Saline (PBS) без Са и Мg
- Магнитный сепаратор (One Lambda или аналог)
- Аспиратор/пипетки Пастера
- Пробирки на 15 и 5 мл с крышками
- Микроцентрифуга или настольная центрифуга
- McCoy’s Media или RPMI с 5% heat inactivated FСS (HIFCS)
Пошаговая процедура:
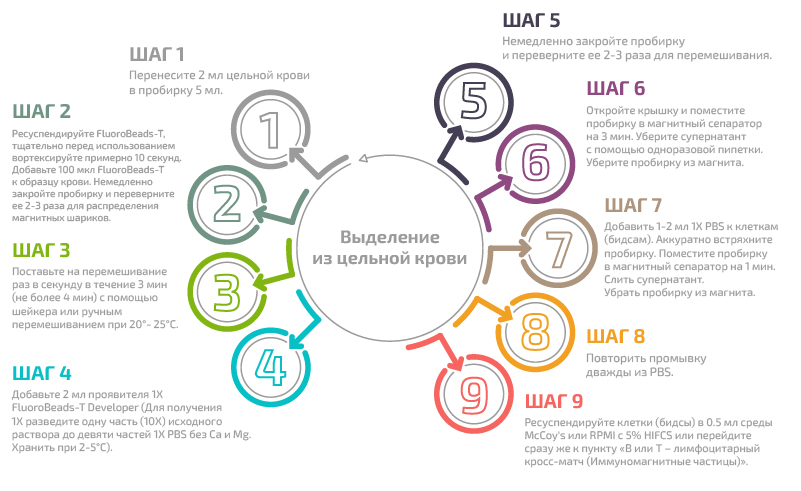
Выделение из цельной крови
В) Выделение В лимфоцитов с помощью специфического реагента FluoroBeads®-B
Реагенты и оборудование:
- Набор FluoroBeads®-B
- PBS/Citrate реагент (Кат.#PC1-500)
- Магнитный сепаратор (One Lambda или аналог)
- Аспиратор/пипетки Пастера
- Пробирки на 15 мл
- Микроцентрифугa или настольная центрифуга
- Phosphate Buffered Saline (PBS) без Са и Мg
- McCoy’s Media или RPMI с 0.5% heat inactivated FСS (HIFCS)
Пошаговая процедура:
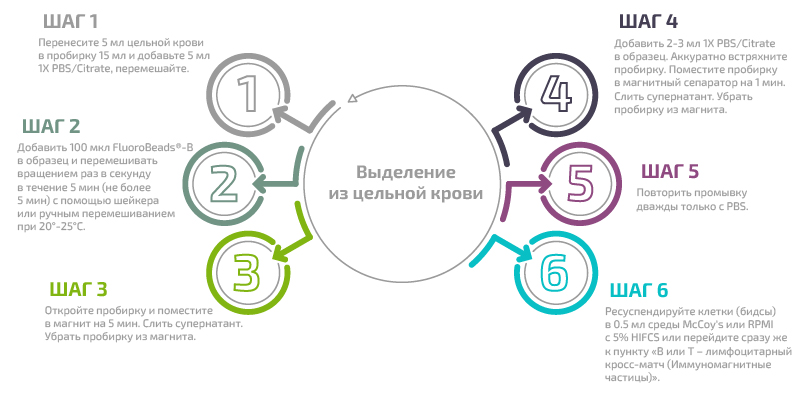
Выделение из цельной крови
О процедуре проведения серологического кросс-матча подробно расскажем в следующей статье.