Примітка: стаття є перекладом матеріалу, підготованого нашим партнером, компанією Horiba. Оригінальна стаття доступна за посиланням.
Цукор, один із найпоширеніших харчових інгредієнтів, входить до складу численних продуктів, зокрема десертів і напоїв. Його виробництво включає кілька етапів — екстракцію, очищення, кристалізацію та сушіння — кожен із яких може становити потенційний ризик забруднення через обладнання та пакування на основі пластику. У цій роботі ми демонструємо типовий робочий процес аналізу мікропластику за допомогою мікро-раманівської спектроскопії.
Вступ
У 2022 році Всесвітня організація охорони здоров’я (ВООЗ) опублікувала звіт, у якому наголосила на зростаючій занепокоєності через вплив мікропластику на людину шляхом харчового надходження та інгаляції. Хоча наявні дані щодо рівня впливу та можливих наслідків для здоров’я залишаються обмеженими, ВООЗ підкреслила нагальну потребу у подальших дослідженнях, особливо зосереджених на найдрібніших частинках мікропластику (<10 мкм), та закликала до розробки стандартизованих методів для отримання надійних даних про вплив на людину.
Серед доступних аналітичних методик мікро-раманівська спектроскопія вирізняється як єдиний еталонний метод, здатний надавати вичерпну інформацію про частинки мікропластику в цьому критично важливому діапазоні розмірів [1]. Аналіз за допомогою Рамана дає змогу визначати кількість частинок, їх хімічний склад і розподіл за розміром, що робить цей метод незамінним інструментом для розвитку досліджень мікропластику та оцінки ризиків.
У цій статті ми продемонструємо, як Раман спектроскопія може ефективно застосовуватися для виявлення та характеристики мікропластику в харчових матрицях. Використовуючи цукор як модельний зразок, ми надаємо покроковий робочий процес підготовки зразка, проведення раманівського аналізу та інтерпретації даних, щоб підкреслити потенціал цього методу для рутинного моніторингу мікропластику в харчових продуктах.
У матеріалі ви дізнаєтесь:
- Як підготувати зразки для аналізу мікропластику, використовуючи фільтрувальний комплект HORIBA, оптимізований для максимального вилучення дрібних частинок.
- Як аналізувати тисячі частинок у повністю автоматизованому робочому процесі за допомогою останнього покоління раманівського мікроскопа LabRAM Soleil™, в поєднанні з потужним програмним забезпеченням ParticleFinder™ для виявлення частинок та збору спектрів.
- Як швидко та надійно ідентифікувати тисячі раманівських спектрів за допомогою інтегрованого модуля IDFinder™, що є частиною програмного комплексу LabSpec 6, який спрощує класифікацію частинок на основі спеціалізованої спектральної бази даних.
- Як зібрати, інтерпретувати та надійно звітувати про результати — кількісно оцінюючи наявність мікропластику в зразку та розрізняючи мікропластик, що походить із зразка, і той, що був внесений під час процесу підготовки зразка.
Цей комплексний робочий процес надає надійний підхід для виявлення та характеристики мікропластику в харчових матрицях, підтримуючи розробку узгоджених протоколів для майбутнього рутинного моніторингу та регуляторних досліджень.
Інструмент та методи
Підготовка зразків
Для цього дослідження 5 грамів білого цукру, придбаного в місцевому супермаркеті, його було розчинено в 500 мл гарячої води Milli-Q для повного розчинення кристалів цукру. Отриманий розчин профільтрували через кремнієвий (Si) фільтр із розміром пор 5 мкм, використовуючи фільтраційний набір HORIBA
(Рисунок 1). На етапі фільтрації всі нерозчинні частинки, присутні в зразку цукру, було сконцентровано на поверхні фільтра, що полегшило подальший раманівський аналіз.
Для забезпечення точності даних та врахування можливого забруднення під час підготовки зразків було підготовлено аналітичні «бланки» шляхом фільтрації 500 мл гарячої води Milli-Q через такі самі Si-фільтри з порами 5 мкм. Ці бланки допомагали з виявленням будь-якого забруднення з навколишнього середовища, яке могло бути внесене в процесі підготовки зразків.
Вибір Si-фільтрів є ключовим елементом цього аналітичного робочого процесу. Їхня плоска відбивна поверхня спрощує автоматизоване виявлення та візуалізацію частинок під час раманівського аналізу. Крім того, кремній генерує мінімальні та чітко визначені раманівські сигнали, що зменшує фонові перешкоди та запобігає перекриванню з характерними раманівськими «відбитками» полімерних частинок. Ця властивість суттєво підвищує точність ідентифікації мікропластику навіть у складних харчових матрицях.

Рисунок 1. Комплект для фільтрації: скляна лійка, скляна основа, силіконова пробка, скляна колба, вакуумний насос та кремнієві фільтри (пористість 5 мкм).
Раманівський аналіз
Раманівський аналіз було проведено з використанням раманівського мікроскопа LabRAM Soleil™ (Рисунок 2). Для аналізу частинок, включно з автоматизованим збором раманівських спектрів, підрахунком частинок та визначенням їх розмірних характеристик, застосовувалося програмне забезпечення ParticleFinder™, яке є модулем у складі LabSpec 6.

Рисунок 2. Раманівський мікроскоп LabRAM Soleil
Для підвищення оптичного контрасту частинок на Si-фільтрі було використано темнопольне освітлення, що полегшило їх автоматичну локалізацію за допомогою ParticleFinder. Після визначення положення частинок на зображенні, для кожної з них було зареєстровано раманівський спектр із використанням лазера на довжині хвилі 532 нм.
Фільтр було проаналізовано в так званому «Динамічному режимі», що означає автоматичне повторення наступної аналітичної послідовності для невеликих ділянок фільтра, які охоплювали кілька полів зору оптичного об’єктива:
- Отримання зображень
- Автоматична локалізація частинок
- Запис Раман спектрів
Такий підхід є особливо ефективним для аналізу великих фільтрів, оскільки мінімізує ризик зміщення частинок під впливом зовнішніх чинників під час аналізу та забезпечує високу точність у локалізації та визначенні розмірів частинок.
Обробка даних
Окрім базової корекції, до спектрів не застосовувалося жодної додаткової обробки. Ідентифікацію спектрів виконували за допомогою програмного забезпечення IDFinder™ (частина пакета LabSpec 6). Спектри порівнювали зі спеціалізованою спектральною бібліотекою і для кожного спектра призначався коефіцієнт відповідності під назвою Hit Quality Index (HQI). Для обчислення HQI використовувалася кореляція Пірсона (Рисунок 3). Сполука з найвищим HQI вважалася хімічною ідентичністю частинки. Мінімально прийнятний показник HQI для автоматичної ідентифікації частинки був встановлений на рівні 60%.
Спектральну бібліотеку було налаштовано таким чином, щоб вона включала спектри 10 найбільш поширених полімерів (перелічених у Таблиці 1), а також типових непластикових матеріалів (таких як Si, аморфний вуглець, целюлоза, білки, CaCO₃, TiO₂ тощо). Варто зазначити, що наведений перелік становить базовий вміст спектральної бібліотеки, адаптованої для аналізу мікропластику, яку можна доповнювати іншими органічними та неорганічними сполуками, очікуваними у зразках.
Таблиця 1. Список найпоширеніших полімерів, включених до базової спектральної бібліотеки для аналізу мікропластику.
| Polymer |
Abbreviation |
| Polyethylene | PE |
| Polypropylene | PP |
| Polyethylene terephthalate | PET |
| Polycarbonate | PC |
| Polystyrene | PS |
| Polytetrafluoroethylene | PTFE |
| Polyvinyl chloride | PVC |
| Polyamide | PA |
| Polymethyl methacrylate | PMMA |
| Polyurethane | PU |
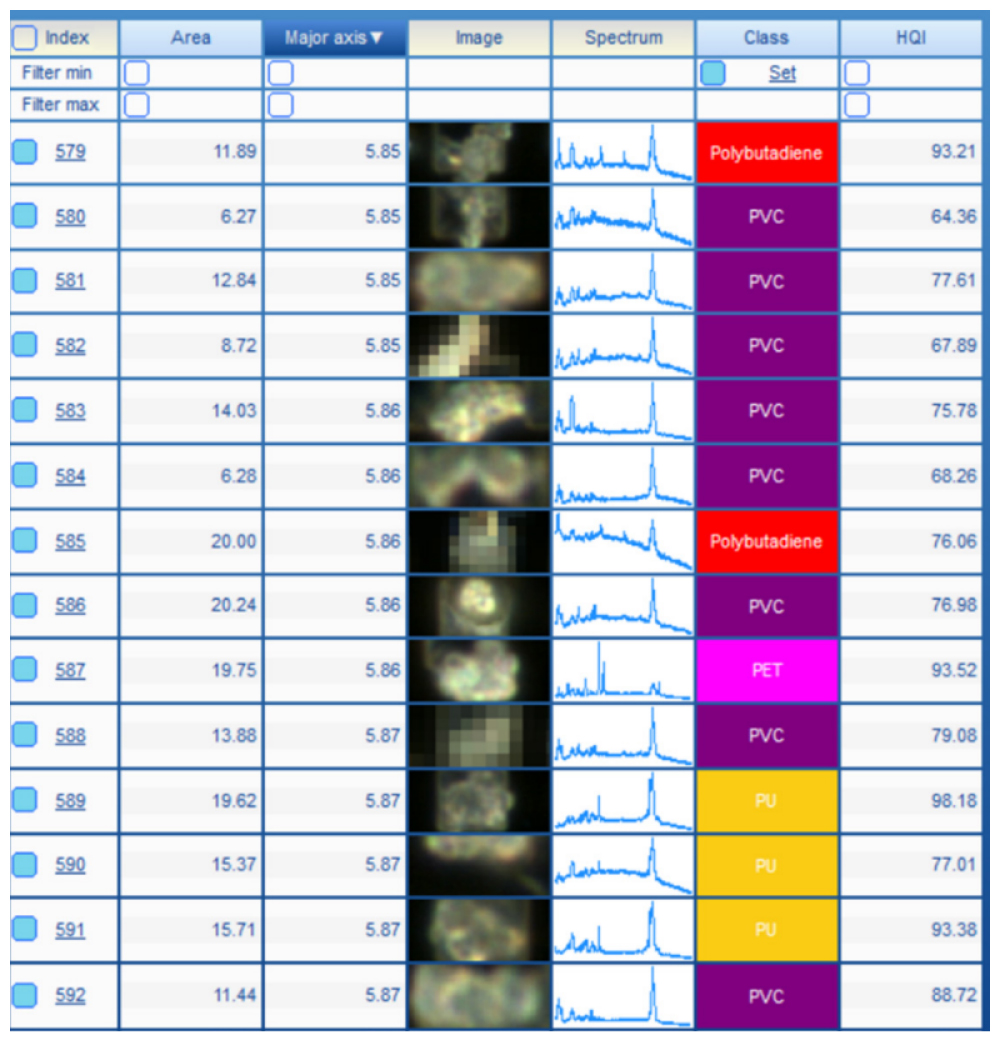
Рисунок 3. Витяг із таблиці результатів: кожен спектр порівнюється зі спеціальною спектральною бібліотекою, компонент із найвищим показником відповідності (Hit Quality Index, HQI) згадується у стовпці «Клас».
Результати та обговорення
Фільтри для раманівського аналізу
На Рисунку 4 наведено оптичні зображення фільтрів, що відповідають зразку цукру та аналітичним бланкам. Чітко помітна візуальна відмінність: у зразку цукру було виявлено значно більше частинок порівняно з бланком, що свідчить про наявність нерозчинних залишків, які не можна віднести до забруднення з навколишнього середовища під час підготовки зразка. Слід зазначити, що хоча цукор розчиняється у воді, залишки матриці все ж можуть залишатися на фільтрі. Тому для успішного аналізу окремих частинок за допомогою Раманівської спектроскопії масу проби слід коригувати, щоб уникнути перекриття частинок, водночас зберігаючи репрезентативну кількість зразка для аналізу. Для більш складних харчових матриць, які не розчиняються у воді, можуть знадобитися додаткові етапи підготовки зразка — такі як хімічне розкладання та/або розділення за густиною — перед фільтрацією на кремнієвому (Si) фільтрі (приклади підготовки зразків наведені [2] та в електронній книзі HORIBA з мікропластику).

Рисунок 4. Оптичні зображення проаналізованих фільтрів.
Ідентифікація частинок
Результати ідентифікації та підрахунку частинок узагальнені на Рисунку 5 (a). Для зручності частинки, ідентифіковані як целюлоза, мінерали, білки, жирні кислоти або аморфний вуглець, були об’єднані в одну категорію під назвою «непластики». Більшість спектрів, віднесених до аномальних (визначених як ті, що мають індекс якості збігу (HQI) нижче 60%), або не містили чіткого Раманівського сигналу через інтерференцію флуоресценції, або демонстрували лише характерний піковий сигнал кремнієвого (Si) фільтра. На Рисунку 5 (b) показано розподіл за розмірами виявлених частинок мікропластику. Дані показують, що більшість мікропластиків, виявлених у зразку цукру, мають розмір менше 20 мкм, що підкреслює важливість використання Раманівської спектроскопії для виявлення дрібних частинок, розмір яких зазвичай нижчий за межу виявлення інших методик.
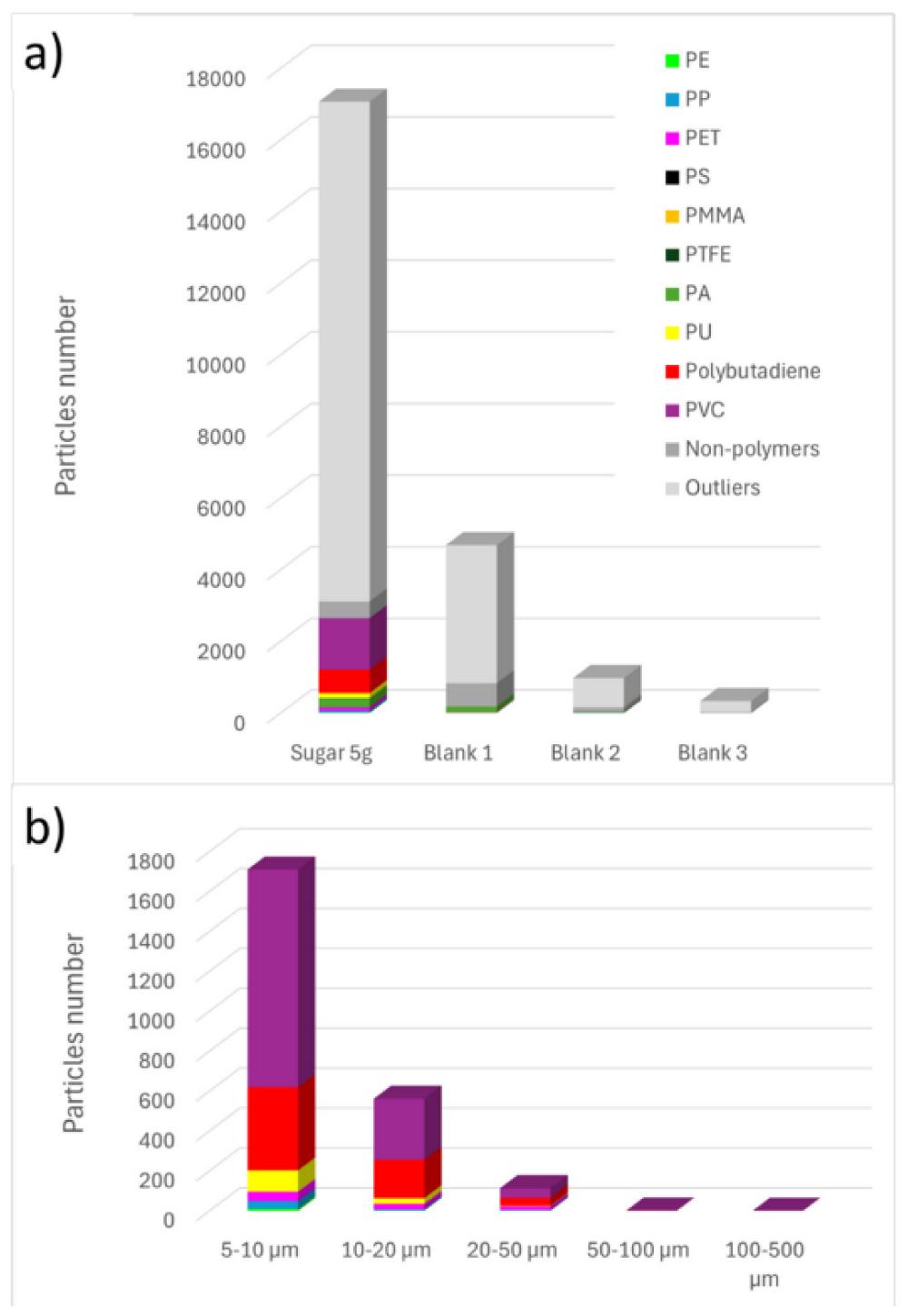
Рисунок 5. Результати Раманівського аналізу для частинок з діаметром Фере > 5 мкм: a) Кількість частинок у зразку цукру та в холостих пробах; b) Розподіл розмірів мікропластику у зразку цукру. На цьому рисунку враховуються значення > LOD.
Окрім стандартних спектрів, включених до бібліотеки для аналізу мікропластику, у зразку цукру було виявлено додатковий спектр. Цей спектр був ідентифікований як суміш акрилонітрил-бутадієнового кополімеру та діоксиду титану (TiO₂) з використанням спектральних бібліотек ST Japan та HORIBA (Рисунок 6). Для спрощення автоматичної ідентифікації та підрахунку подібних частинок цей спектр було додано до довідкової бібліотеки та позначено як «Полібутадієн» для зручності подальшого аналізу.
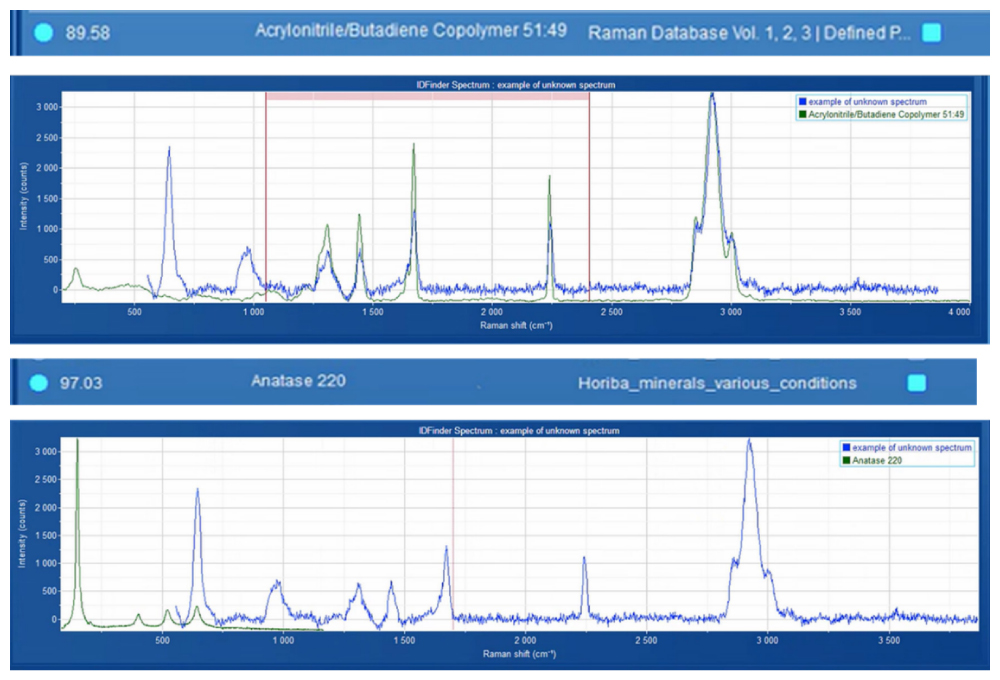
Рисунок 6. Ідентифікація невідомого спектра за допомогою програмного забезпечення ID Finder™. Зареєстрований невідомий спектр (синій) був порівняний із записами з спектральних бібліотек ST Japan та HORIBA (зелений). Найкраще співпадіння було ідентифіковано як комбінація акрилонітрил-бутадієнного кополімеру та діоксиду титану (анатаз).
Звітування про результати та управління бланковими пробами
Щоб оцінити значущість виявленого мікропластику, для кожного полімеру було розраховано межу виявлення (LOD) за допомогою такої формули:
LOD (полімер) = Середнє значення (бланки) + 3 × Стандартне відхилення (бланки)
Де середнє значення (бланки) — це середня кількість мікрочастинок певного полімеру, виявлених у холостих зразках, а стандартне відхилення (бланки) — це показник варіабельності для цього полімеру між вимірюваннями холостих зразків.
Щоб підтвердити наявність певного полімеру в зразку цукру, кількість виявлених частинок порівнювали з межею виявлення (LOD) для цього полімеру. Якщо кількість частинок перевищувала LOD, полімер вважався присутнім у зразку на статистично значущому рівні, вище фонових забруднень. У таблиці 2 наведено розраховані значення LOD для кожного полімеру та відповідну кількість частинок у зразку цукру. На основі цього порівняння підтверджено наявність PE (поліетилену), PP (поліпропілену), PET (поліетилентерефталату), PVC (полівінілхлориду), PU (поліуретану) та полібутадієну. Серед них найбільш поширеними були PVC, PU та полібутадієн. Наявність PA (поліаміду) залишається невизначеною через подібні рівні, виявлені у холостих зразках, що вказує на можливе забруднення під час обробки чи фільтрації.
| Polymer | LOD
Particles number |
Sugar Particles number |
| Polyethylene | 2 | 14 |
| Polypropylene | 14 | 45 |
| Polyethylene terephthalate | 20 | 93 |
| Polystyrene | 4 | 2 |
| Polyamide | 289 | 262 |
| Polyvinyl chloride | 6 | 1442 |
| Polyurethane | 2 | 139 |
| Polytetrafluoroethylene | 1 | 1 |
| Polymethyl methacrylate | 1 | 0 |
| Polycarbonate | 1 | 0 |
| Polybutadiene | 2 | 651 |
Таблиця 2. Межа виявлення (LOD) частинок мікропластику та результати зразка цукру. LOD розраховувалася для кожного типу полімеру за формулою LOD = Середнє значення холостих зразків + 3 стандартних відхилення холостих зразків. Значення, виділені червоним, перевищують межу виявлення.
Висновки
У цій прикладній нотатці продемонстровано можливості Раманівської мікроспектроскопії для виявлення, ідентифікації та кількісного визначення мікропластику в харчових продуктах, використовуючи білий цукор як тестовий зразок. Застосований робочий процес — поєднання фільтраційного набору HORIBA, Раманівського мікроскопа LabRAM Soleil™ та автоматизованого аналізу за допомогою ParticleFinder™ і IDFinder™ — виявився ефективним для характеристики мікропластику розміром менше ніж 20 мкм.
У зразку цукру було ідентифіковано кілька типів полімерів, зокрема PVC, PU та полібутадієн, при цьому більшість частинок мали розмір менше 20 мкм. Стійка наявність цих полімерів порушує важливі питання щодо їхнього походження. Потенційними джерелами можуть бути обладнання для обробки харчових продуктів (наприклад, конвеєрні стрічки, ущільнювачі чи пакування), забруднення з довкілля під час виробництва або транспортування, а також добавки чи допоміжні речовини, що використовуються при рафінуванні цукру. Ці результати підкреслюють необхідність подальших досліджень шляхів потрапляння мікропластику до харчового ланцюга. Зокрема, виявлення частинок розміром менше 20 мкм, які викликають дедалі більші занепокоєння через потенційний вплив на здоров’я людини, узгоджується з рекомендаціями ВООЗ 2022 року щодо покращення даних про вплив на людину та розробки стандартизованих аналітичних методів.
Ми закликаємо дослідників розширювати дослідження різних харчових матриць та вивчати токсикологічну значущість різних типів і розмірів полімерів. Водночас виробникам і постачальникам харчових продуктів рекомендується розпочати регулярний моніторинг своїх сировинних матеріалів та виробничого середовища, щоб забезпечити найвищі стандарти якості та завчасно підготуватися до майбутніх регуляторних вимог.
Представлена методологія пропонує надійне та масштабоване рішення для підтримки цих зусиль і сприяє кращому розумінню впливу мікропластику через раціон.
Джерела:
1. N. P. Ivleva, “Chemical Analysis of Microplastics and Nanoplastics: Challenges, Advanced Methods, and Perspectives,” Chemical Reviews, vol. 121, no. 19,
2. P. A. Da Costa Filho, D. Andrey, B. Eriksen, R. Peixoto, B. Carreres, M. E. Ambühl, J. B. Descarrega,
- Dubascoux, P. Zbinden, A. Panchaud and E. Poitevin, “Detection and characterization of small- sized microplastics (≥ 5 µm) in milk products,” Sci Rep., vol. 11, no. 1, p. 24046, 2021.
3. World Health Organization, “Dietary and inhalation exposure to nano- and microplastic particles and potential implications for human health,” Geneva, 2022.
