Примечание: статья является переводом материала, подготовленного нашим партнером, компанией Horiba. Оригинальная статья доступна по ссылке.
Сахар, один из самых распространенных пищевых ингредиентов, входит в состав многочисленных продуктов, в частности десертов и напитков. Его производство включает несколько этапов — экстракцию, очистку, кристаллизацию и сушку — каждый из которых может представлять потенциальный риск загрязнения из-за оборудования и упаковки на основе пластика. В этой работе мы демонстрируем типичный рабочий процесс анализа микропластика с помощью микро-рамановской спектроскопии.
Введение
В 2022 году Всемирная организация здравоохранения (ВОЗ) опубликовала отчет, в котором подчеркнула растущую обеспокоенность по поводу воздействия микропластика на человека через пищевое поступление и ингаляцию. Хотя имеющиеся данные об уровне воздействия и возможных последствиях для здоровья остаются ограниченными, ВОЗ подчеркнула настоятельную необходимость в дальнейших исследованиях, особенно сосредоточенных на мельчайших частицах микропластика (<10 мкм), и призвала к разработке стандартизированных методов для получения надежных данных о воздействии на человека.
Среди доступных аналитических методик микро-рамановская спектроскопия выделяется как единственный эталонный метод, способный предоставлять исчерпывающую информацию о частицах микропластика в этом критически важном диапазоне размеров [1]. Анализ с помощью Рамана позволяет определять количество частиц, их химический состав и распределение по размеру, что делает этот метод незаменимым инструментом для развития исследований микропластика и оценки рисков.
В этой статье мы продемонстрируем, как Раман-спектроскопия может эффективно применяться для выявления и характеристики микропластика в пищевых матрицах. Используя сахар в качестве модельного образца, мы предоставляем пошаговый рабочий процесс подготовки образца, проведения рамановского анализа и интерпретации данных, чтобы подчеркнуть потенциал этого метода для рутинного мониторинга микропластика в пищевых продуктах.
В материале вы узнаете:
- Как подготовить образцы для анализа микропластика, используя фильтрующий комплект HORIBA, оптимизированный для максимального извлечения мелких частиц.
- Как анализировать тысячи частиц в полностью автоматизированном рабочем процессе с помощью последнего поколения рамановского микроскопа LabRAM Soleil™ в сочетании с мощным программным обеспечением ParticleFinder™ для обнаружения частиц и сбора спектров.
- Как быстро и надежно идентифицировать тысячи рамановских спектров с помощью интегрированного модуля IDFinder™, который является частью программного комплекса LabSpec 6, упрощающего классификацию частиц на основе специализированной спектральной базы данных.
- Как собрать, интерпретировать и надежно отчитаться о результатах — количественно оценивая наличие микропластика в образце и различая микропластик, происходящий из образца, и тот, который был внесен во время процесса подготовки образца.
Этот комплексный рабочий процесс предоставляет надежный подход для выявления и характеристики микропластика в пищевых матрицах, поддерживая разработку согласованных протоколов для будущего рутинного мониторинга и регуляторных исследований.
Инструменты и методы
Подготовка образцов
Для этого исследования 5 граммов белого сахара, приобретенного в местном супермаркете, было растворено в 500 мл горячей воды Milli-Q для полного растворения кристаллов сахара. Полученный раствор профильтровали через кремниевый (Si) фильтр с размером пор 5 мкм, используя фильтрационный набор HORIBA
(Рисунок 1). На этапе фильтрации все нерастворимые частицы, присутствующие в образце сахара, были сконцентрированы на поверхности фильтра, что облегчило дальнейший рамановский анализ.
Для обеспечения точности данных и учета возможного загрязнения при подготовке образцов были подготовлены аналитические «бланки» путем фильтрации 500 мл горячей воды Milli-Q через такие же Si-фильтры с порами 5 мкм. Эти бланки помогали выявить любое загрязнение из окружающей среды, которое могло быть внесено в процессе подготовки образцов.
Выбор Si-фильтров является ключевым элементом этого аналитического рабочего процесса. Их плоская отражающая поверхность упрощает автоматизированное обнаружение и визуализацию частиц во время рамановского анализа. Кроме того, кремний генерирует минимальные и четко определенные рамановские сигналы, что уменьшает фоновые помехи и предотвращает перекрытие с характерными Рамановскими «отпечатками» полимерных частиц. Это свойство существенно повышает точность идентификации микропластика даже в сложных пищевых матрицах.

Рисунок 1. Комплект для фильтрации: стеклянная воронка, стеклянная основа, силиконовая пробка, стеклянная колба, вакуумный насос и кремниевые фильтры (пористость 5 мкм).
Рамановский анализ
Рамановский анализ был проведен с использованием рамановского микроскопа LabRAM Soleil™ (Рисунок 2). Для анализа частиц, включая автоматизированный сбор рамановских спектров, подсчет частиц и определение их размерных характеристик, применялось программное обеспечение ParticleFinder™, которое является модулем в составе LabSpec 6.

Рисунок 2. Рамановский микроскоп LabRAM Soleil
Для повышения оптического контраста частиц на Si-фильтре было использовано темнопольное освещение, что облегчило их автоматическую локализацию с помощью ParticleFinder. После определения положения частиц на изображении, для каждой из них был зарегистрирован рамановский спектр с использованием лазера на длине волны 532 нм.
Фильтр был проанализирован в так называемом «динамическом режиме», что означает автоматическое повторение следующей аналитической последовательности для небольших участков фильтра, которые охватывали несколько полей зрения оптического объектива:
- Получение изображений
- Автоматическая локализация частиц
- Запись Раман-спектров
Такой подход особенно эффективен для анализа больших фильтров, поскольку минимизирует риск смещения частиц под воздействием внешних факторов во время анализа и обеспечивает высокую точность в локализации и определении размеров частиц.
Обработка данных
Кроме базовой коррекции, к спектрам не применялась никакая дополнительная обработка. Идентификацию спектров выполняли с помощью программного обеспечения IDFinder™ (часть пакета LabSpec 6). Спектры сравнивались со специализированной спектральной библиотекой и для каждого спектра назначался коэффициент соответствия под названием Hit Quality Index (HQI). Для вычисления HQI использовалась корреляция Пирсона (Рисунок 3). Соединение с самым высоким HQI считалось химической идентичностью частицы. Минимально приемлемый показатель HQI для автоматической идентификации частицы был установлен на уровне 60%.
Спектральная библиотека была настроена таким образом, чтобы она включала спектры 10 наиболее распространенных полимеров (перечисленных в Таблице 1), а также типичных непластиковых материалов (таких как Si, аморфный углерод, целлюлоза, белки, CaCO₃, TiO₂ и т. д.). Стоит отметить, что приведенный перечень составляет базовое содержание спектральной библиотеки, адаптированной для анализа микропластика, которую можно дополнять другими органическими и неорганическими соединениями, ожидаемыми в образцах.
Таблица 1. Список наиболее распространенных полимеров, включенных в базовую спектральную библиотеку для анализа микропластика.
| Polymer | Abbreviation |
| Polyethylene | PE |
| Polypropylene | PP |
| Polyethylene terephthalate | PET |
| Polycarbonate | PC |
| Polystyrene | PS |
| Polytetrafluoroethylene | PTFE |
| Polyvinyl chloride | PVC |
| Polyamide | PA |
| Polymethyl methacrylate | PMMA |
| Polyurethane | PU |
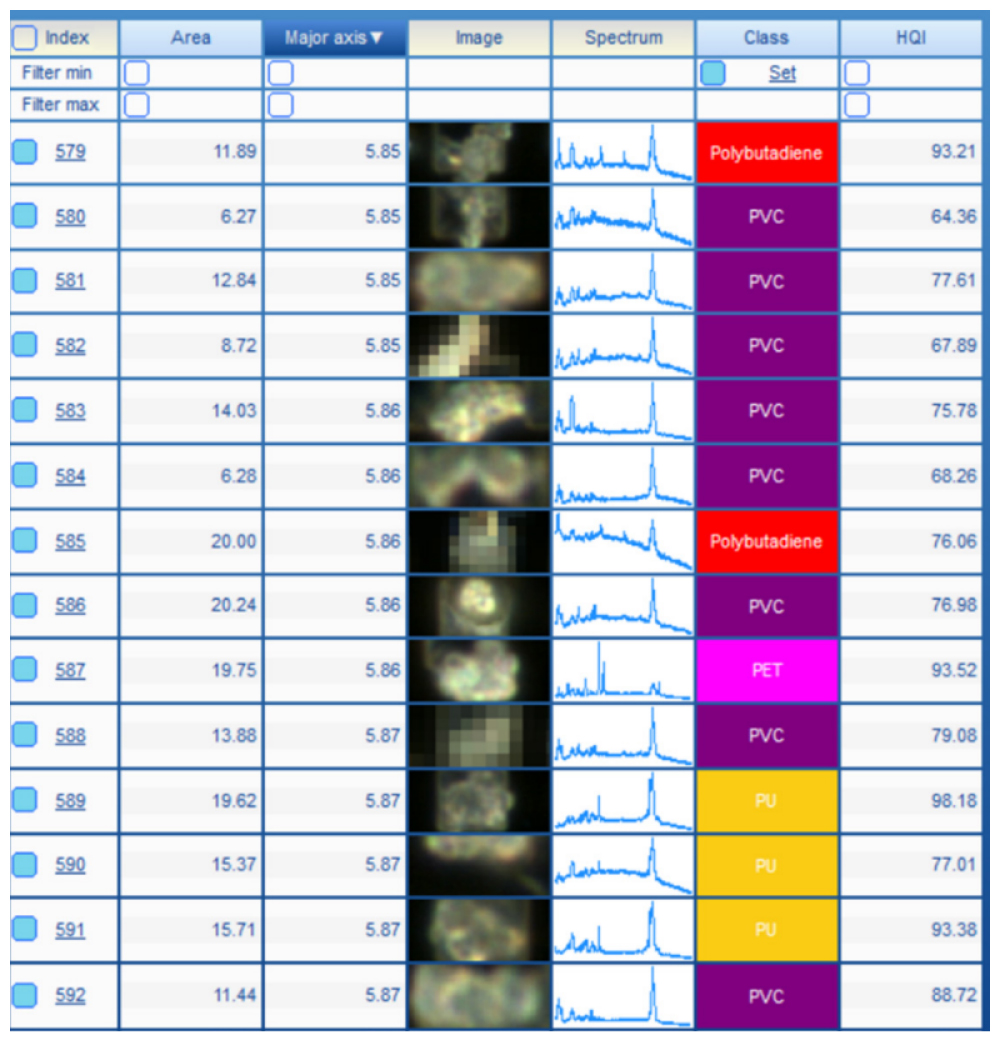
Рисунок 3. Выдержка из таблицы результатов: каждый спектр сравнивается со специальной спектральной библиотекой, компонент с наивысшим показателем соответствия (Hit Quality Index, HQI) упоминается в столбце «Класс».
Результаты и обсуждение
Фильтры для рамановского анализа
На рисунке 4 представлены оптические изображения фильтров, соответствующих образцу сахара и аналитическим бланкам. Четко заметно визуальное отличие: в образце сахара было обнаружено значительно больше частиц по сравнению с бланком, что свидетельствует о наличии нерастворимых остатков, которые нельзя отнести к загрязнению из окружающей среды во время подготовки образца. Следует отметить, что хотя сахар растворяется в воде, остатки матрицы все же могут оставаться на фильтре. Поэтому для успешного анализа отдельных частиц с помощью Рамановской спектроскопии массу пробы следует корректировать, чтобы избежать перекрытия частиц, сохраняя при этом репрезентативное количество образца для анализа. Для более сложных пищевых матриц, которые не растворяются в воде, могут потребоваться дополнительные этапы подготовки образца — такие как химическое разложение и/или разделение по плотности — перед фильтрацией на кремниевом (Si) фильтре (примеры подготовки образцов приведены [2] и в электронной книге HORIBA по микропластику).

Рисунок 4. Оптические изображения проанализированных фильтров.
Идентификация частиц
Результаты идентификации и подсчета частиц обобщены на рисунке 5 (a). Для удобства частицы, идентифицированные как целлюлоза, минералы, белки, жирные кислоты или аморфный углерод, были объединены в одну категорию под названием «непластики». Большинство спектров, отнесенных к аномальным (определенных как имеющие индекс качества совпадения (HQI) ниже 60%), либо не содержали четкого Рамановского сигнала из-за интерференции флуоресценции, либо демонстрировали только характерный пиковый сигнал кремниевого (Si) фильтра. На рисунке 5 (b) показано распределение по размерам обнаруженных частиц микропластика. Данные показывают, что большинство микропластиков, обнаруженных в образце сахара, имеют размер менее 20 мкм, что подчеркивает важность использования Рамановской спектроскопии для обнаружения мелких частиц, размер которых обычно ниже предела обнаружения других методик.
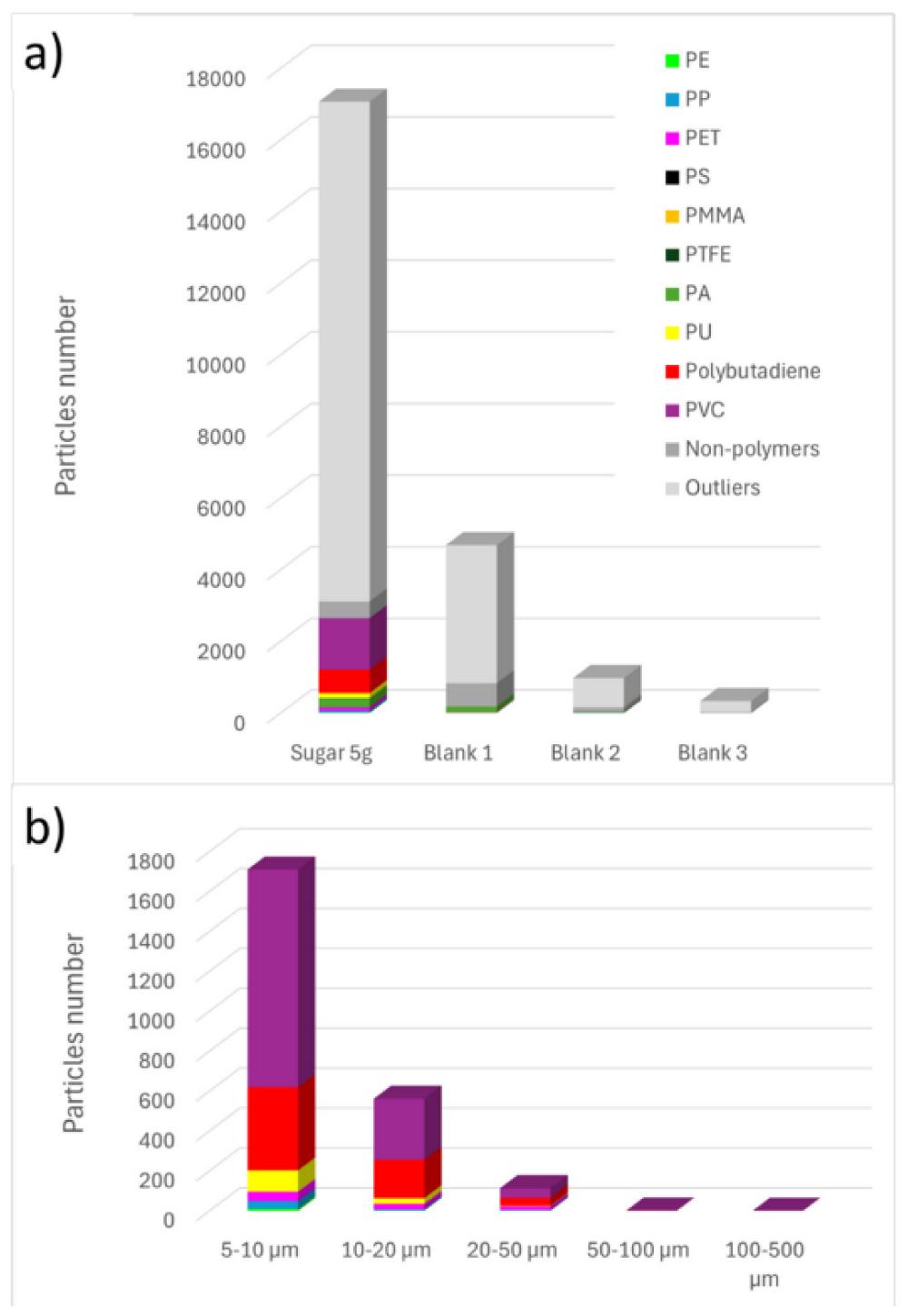
Рисунок 5. Результаты Рамановского анализа для частиц с диаметром Фере > 5 мкм: a) Количество частиц в образце сахара и в холостых пробах; b) Распределение размеров микропластика в образце сахара. На этом рисунке учитываются значения > LOD.
Кроме стандартных спектров, включенных в библиотеку для анализа микропластика, в образце сахара был обнаружен дополнительный спектр. Этот спектр был идентифицирован как смесь акрилонитрил-бутадиенового сополимера и диоксида титана (TiO₂) с использованием спектральных библиотек ST Japan и HORIBA (Рисунок 6). Для упрощения автоматической идентификации и подсчета подобных частиц этот спектр был добавлен в справочную библиотеку и обозначен как «Полибутадиен» для удобства дальнейшего анализа.
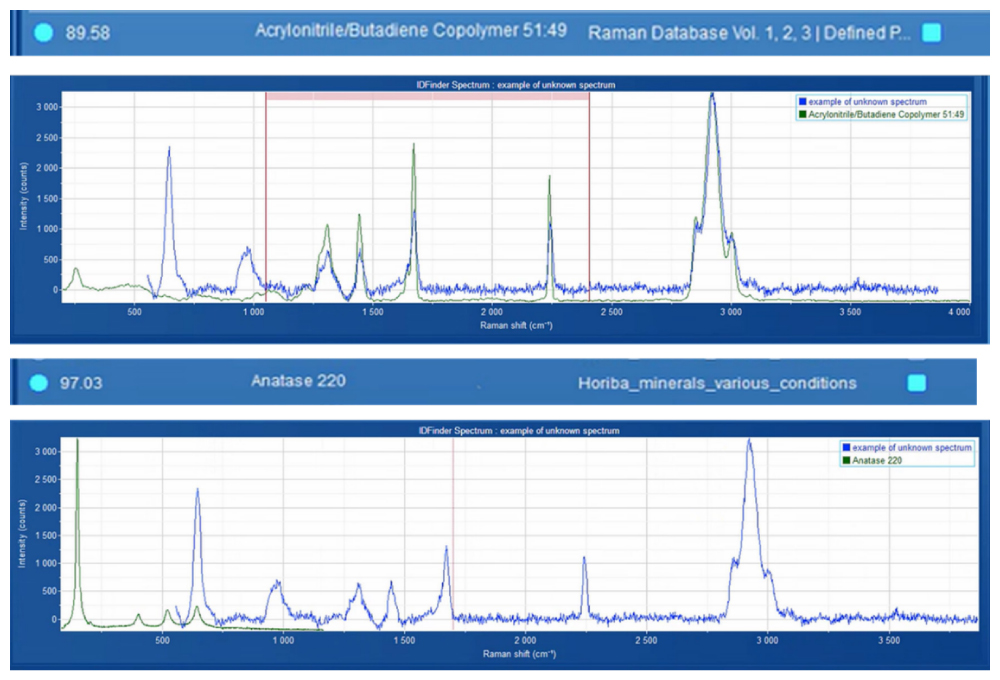
Рисунок 6. Идентификация неизвестного спектра с помощью программного обеспечения ID Finder™. Зарегистрированный неизвестный спектр (синий) был сравнен с записями из спектральных библиотек ST Japan и HORIBA (зеленый). Наилучшее совпадение было идентифицировано как комбинация акрилонитрил-бутадиенового сополимера и диоксида титана (анатаз).
Отчетность о результатах и управление бланковыми пробами
Чтобы оценить значимость обнаруженного микропластика, для каждого полимера был рассчитан предел обнаружения (LOD) с помощью следующей формулы:
LOD (полимер) = Среднее значение (бланки) + 3 × Стандартное отклонение (бланки)
Где среднее значение (бланки) — это среднее количество микрочастиц определенного полимера, обнаруженных в холостых образцах, а стандартное отклонение (бланки) — это показатель вариабельности для этого полимера между измерениями холостых образцов.
Чтобы подтвердить наличие определенного полимера в образце сахара, количество обнаруженных частиц сравнивали с пределом обнаружения (LOD) для этого полимера. Если количество частиц превышало LOD, полимер считался присутствующим в образце на статистически значимом уровне, выше фоновых загрязнений. В таблице 2 приведены рассчитанные значения LOD для каждого полимера и соответствующее количество частиц в образце сахара. На основе этого сравнения подтверждено наличие PE (полиэтилена), PP (полипропилена), PET (полиэтилентерефталата), PVC (поливинилхлорида), PU (полиуретана) и полибутадиена. Среди них наиболее распространенными были PVC, PU и полибутадиен. Наличие PA (полиамида) остается неопределенным из-за схожих уровней, обнаруженных в холостых образцах, что указывает на возможное загрязнение во время обработки или фильтрации.
| Polymer | LOD
Particles number |
Sugar Particles number |
| Polyethylene | 2 | 14 |
| Polypropylene | 14 | 45 |
| Polyethylene terephthalate | 20 | 93 |
| Polystyrene | 4 | 2 |
| Polyamide | 289 | 262 |
| Polyvinyl chloride | 6 | 1442 |
| Polyurethane | 2 | 139 |
| Polytetrafluoroethylene | 1 | 1 |
| Polymethyl methacrylate | 1 | 0 |
| Polycarbonate | 1 | 0 |
| Polybutadiene | 2 | 651 |
Таблица 2. Предел обнаружения (LOD) частиц микропластика и результаты образца сахара. LOD рассчитывался для каждого типа полимера по формуле LOD = Среднее значение холостых образцов + 3 стандартных отклонения холостых образцов. Значения, выделенные красным, превышают предел обнаружения.
Выводы
В этой прикладной заметке продемонстрированы возможности Рамановской микроспектроскопии для обнаружения, идентификации и количественного определения микропластика в пищевых продуктах, используя белый сахар в качестве тестового образца. Примененный рабочий процесс — сочетание фильтрационного набора HORIBA, Рамановского микроскопа LabRAM Soleil™ и автоматизированного анализа с помощью ParticleFinder™ и IDFinder™ — оказался эффективным для характеристики микропластика размером менее 20 мкм.
В образце сахара было идентифицировано несколько типов полимеров, в частности PVC, PU и полибутадиен, при этом большинство частиц имели размер менее 20 мкм. Устойчивое наличие этих полимеров поднимает важные вопросы об их происхождении. Потенциальными источниками могут быть оборудование для обработки пищевых продуктов (например, конвейерные ленты, уплотнители или упаковка), загрязнение из окружающей среды во время производства или транспортировки, а также добавки или вспомогательные вещества, используемые при рафинировании сахара. Эти результаты подчеркивают необходимость дальнейших исследований путей попадания микропластика в пищевую цепочку. В частности, обнаружение частиц размером менее 20 мкм, которые вызывают все большее беспокойство из-за потенциального воздействия на здоровье человека, согласуется с рекомендациями ВОЗ 2022 года по улучшению данных о воздействии на человека и разработке стандартизированных аналитических методов.
Мы призываем исследователей расширять исследования различных пищевых матриц и изучать токсикологическую значимость различных типов и размеров полимеров. В то же время производителям и поставщикам пищевых продуктов рекомендуется начать регулярный мониторинг своих сырьевых материалов и производственной среды, чтобы обеспечить самые высокие стандарты качества и заблаговременно подготовиться к будущим регуляторным требованиям.
Представленная методология предлагает надежное и масштабируемое решение для поддержки этих усилий и способствует лучшему пониманию влияния микропластика через рацион.
Источники:
1. N. P. Ivleva, “Chemical Analysis of Microplastics and Nanoplastics: Challenges, Advanced Methods, and Perspectives,” Chemical Reviews, vol. 121, no. 19,
2. P. A. Da Costa Filho, D. Andrey, B. Eriksen, R. Peixoto, B. Carreres, M. E. Ambühl, J. B. Descarrega,
- Dubascoux, P. Zbinden, A. Panchaud and E. Poitevin, “Detection and characterization of small- sized microplastics (≥ 5 µm) in milk products,” Sci Rep., vol. 11, no. 1, p. 24046, 2021.
3. World Health Organization, “Dietary and inhalation exposure to nano- and microplastic particles and potential implications for human health,” Geneva, 2022.
