Для збереження тканини в максимально наближеному до прижиттєвого стані після її вилучення з організму використовують фіксатори. При цьому стараються підібрати фіксатор, який забезпечить збереження тканини в максимально наближеному до прижиттєвого стані.
Найбільш поширений фіксатор для гістологічних та імуногістологічних досліджень –розчин формаліну. На якість фіксації за допомогою розчину формаліну впливає його: рН, концентрація, забуферений він чи ні, а також час фіксації в ньому тканини.
Найкращим вважається – 10% нейтральний забуферений розчин формаліну (наприклад Формалін гістологічний 10% Leica Neutral Buffered Formalin).
Фіксація в поганому розчині фіксатора, а також неправильний вибір часу фіксації призводить до втрати антигенів або їх дифузії в навколишні тканини.
При цьому, погано зафіксовані тканини не піддаються обробці парафіном і в результаті отримують неякісні парафінові блоки тканин. Кінцевими продуктом стає погано оброблений блок, недостатньо просочений парафіном. Зрізи зроблені з погано оброблених блоків тканин демонструють низьку стійкість до методів демаскування антигенів та призводять до неякісного результату дослідження. Морфологія тканини при цьому втрачається і самі антигени також можуть бути втрачені.
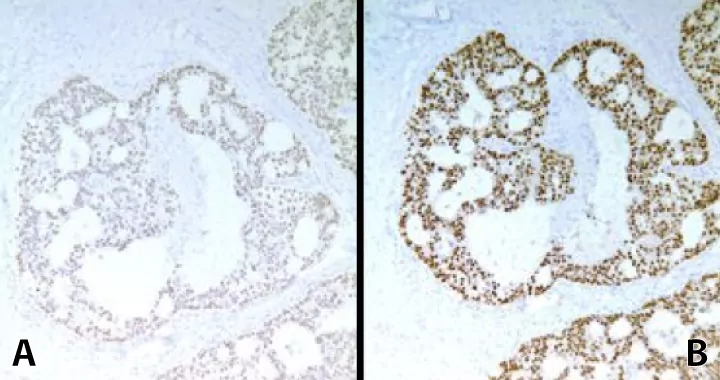
Рис. 1. Забарвлення рецептору естрогену (ER) карциноми молочної залози. А – Фіксація:10% формаліні протягом 3 годин. Результат: демонстрація низького вмісту ER- позитивних клітин. Б – Фіксація:10% формаліні протягом 8 годин. Результат: демонстрація високого вмісту ER- позитивних клітин.
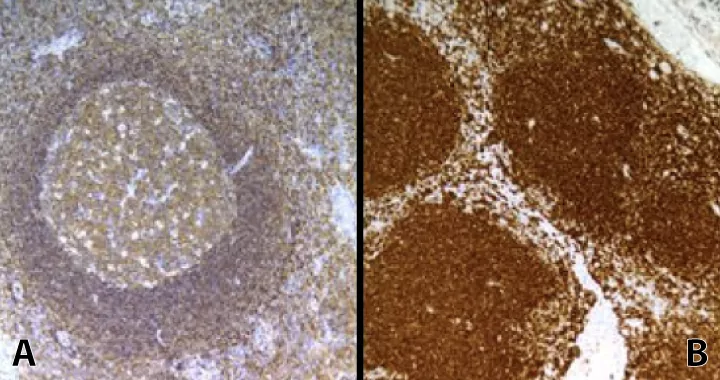
Рис. 2. Забарвлення LCA (CD45) на мигдалині. А. – Блок, який фіксувався в 10% розчині формаліну протягом 3 годин і демонструє низький рівень забарвлення лімфоцитів. В – Блок, який фіксувався в 10% розчині формаліну протягом 8 годин і демонструє високий рівень забарвлення лімфоцитів.
Фіксація сама по собі не являється характерною причиною втрати можливості виявлення тканинних антигенів. Вона втрачається після комбінації фіксації, обробки тканин та інфільтрації парафіном.
Розчин формальдегіду денатурує макромолекули тканин, тим самим робить тканинні білки, які складають більшу частину тканинних антигенів недоступними для взаємодії з первинними антитілами, які використовуються в імуногістохімії.
Для того, щоб побороти зниження імунореактивності тканин (маскування антигенів), внаслідок обробки формаліном та парафіном, були розроблені методи демаскування антигенів.
Індуковані альдегідом поперечні зв’язки можуть бути розірвані шляхом нагрівання до високих температур (теплове індуковане виявлення епітопів, HIER) або за допомогою обробки зрізів тканин розчином ферментів (ферментативне індуковане виявлення епітопів, EIER).
При використанні ферментів велику роль відіграє вибір ферменту, його концентрація і тривалість процедури демаскування. Також впливає температура, рівень рН.
Тривалість ферментативної обробки для демаскування антигена залежить від тривалості фіксації в розчині формаліну. Тканини фіксовані в розчині формаліну протягом довгого проміжку часу переважно вимагають тривалого впливу розчину протеолітичного ферменту.
Основна перевага теплового демаскування епітопів (HIER) полягає в тому, що час нагріву для виявлення антигенів, як правило, стандартний, не залежно від тривалості фіксації.
Серед інших переваг HIER варто відзначити:
- підвищену інтенсивність фарбування;
- демонстрацію антигенів, які не проявляються в фіксованою формаліном тканини в звичайних умовах;
- отримання послідовного, надійного, високоякісного імуногістохімічного фарбування тканинних антигенів.
На якість демаскування антигенів методом HIER впливає правильність вибору розчину для демаскування, в який буде поміщений зріз тканини при проведенні температурного демаскування. Найбільш поширеними є розчин з високим pH (наприклад Розчин для виявлення епітопу Novocastra™ Epitope Retrieval Solutions pH9, x10, Leica Biosystems) та розчин з низьким pH (наприклад Розчин для виявлення епітопу Novocastra™ Epitope Retrieval Solutions pH6, x10, Leica Biosystems). На даний вибір впливає досліджуваний антиген та вибір первинних антитіл.
Також, одним із ключових факторів, які впливають на якість імуногістохімічного дослідження, та залежить від процесу фіксації, є підбір оптимальної концентрації розчину первинних антитіл, яка надає оптимальне специфічне забарвлення при мінімізації фонового забарвлення. Оптимальне розведення залежить від типу і тривалості фіксації. Для окремих лабораторій вкрай важливо знайти розчин для розведення концентрованого розчину первинних антитіл, який дасть оптимальний результат за допомогою використання системи детекції. Таким чином, окремі лабораторії рідко використовують ідентичні розведення первинних антитіл, навіть якщо вони використовують ідентичні імуногістохімічні методики.
Загалом, можна сказати, що від правильного вибору фіксації та обробки ткани буде залежати якість проведеного імуногістохімічного дослідження, яке являє собою інтеграцію декількох параметрів з метою демонстрації антигенів з збереженням цілісності морфології тканини.