С каждым годом количество проверок фармацевтических компаний увеличивается, соответственно, увеличивается и количество замечаний.
Самые распространенные проблемы, которые обнаруживают инспекторы:
- Несоответствие электронных систем документооборота Приложению 11 «Валидация компьютерных систем»
- Неполные данные
- Повторные и неофициальные тестирования
- Запись данных не в контрольные журналы (данные на кусочках бумаги или в ежедневнике)
- Удаление, манипуляции с данными
- Несвоевременная запись данных
Все эти замечания являются частью понятия «целостности данных». Что же означает «целостность данных»? Департамент FDA характеризирует это понятие как «полнота, непротиворечивость и точность собранных данных» (1995), а Агентство регулирования лекарственных средств (MHRA) дает определение «полнота, непротиворечивость и точность собранных данных на протяжении всего жизненного цикла» (2015).
Стоит отметить, что понятие «целостности данных» относится не только к данным, но также включает в себя технический, процедурный контроль и валидацию (рис. 1). Только вместе все эти данные обеспечивают понятие целостности.
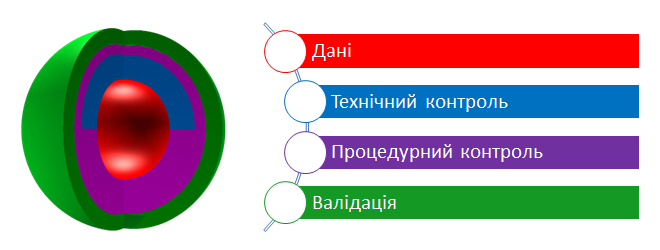
Рис. 1 Уровни целостности данных
Для обеспечения целостности данных необходимо, чтобы они отвечали требованиям ALCOA. Эти требования были разработаны одним из инспекторов FDA в конце 1980-х и со временем были дополнены критериями, которые сейчас и составляют ALCOA+.
Attributable/отслеживаемые — должна быть обеспечена функция идентификации оператора, который выполняет задание. Нужно документировать, кто совершил действие и когда.
Legible/четкие — записи должны быть разборчивые на протяжении всего периода хранения (особенно это актуально для бумажных данных).
Contemporaneous/своевременные — данные должны быть документированы во время проведения анализов.
Original/оригинальные — записи должны быть оригинальными или должна быть их сертифицированная копия.
Accurate/точные — никаких ошибок или редактирования без задокументированных поправок.
Complete/полные – должны присутствовать все данные тестирования, включая повторные анализы.
Consistent/последовательны – все элементы анализа, такие как последовательность действий, имеют дату и время в ожидаемой последовательности и должны быть записаны.
Enduring/надежные – данные записаны в лабораторных журналах или валидированных системах.
Available/доступные – данные должны быть доступны к просмотру, аудиту или инспекции в период существования записи.
Все эти требования к данным должны выполняться соответствующим образом с помощью программного обеспечения.
Документы FDA 21 Part 11 и Annex 11 описывают основные требования к программному обеспечению, которое должно использоваться на фармацевтических предприятиях. Далее мы рассмотрим, как Chromeleon соответствует этим требованиям и делает работу аналитиков проще.
Чтобы данные были отслеживаемыми, а также для соответствия требованиям FDA 21 Part 11, необходимо обеспечить идентификаторы пользователей, а значит, перед началом работы нужно войти в систему (рис.2).
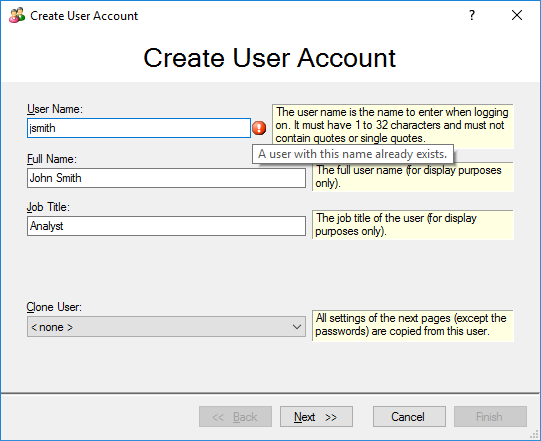
Рис. 2 Пользователи идентифицируются по имени пользователя, полным именем и группе пользователей
Улучшенная система безопасности Chromeleon CDS обеспечивает создание групп пользователей, имеющих разный уровень доступа. Каждой группе дается определенный набор прав, определяющих действия в Chromeleon CDS. Например, руководителям лабораторий обычно даются права для изменения интегрирования, тогда как операторы имеют только права на создание и запуск последовательностей.
В случае попытки использования чужих данных (например, неоднократное введение пароля) или при одновременной работе на нескольких приборах – все эти данные будут отображаться в Журнале аудита управления пользователями (рис. 3).
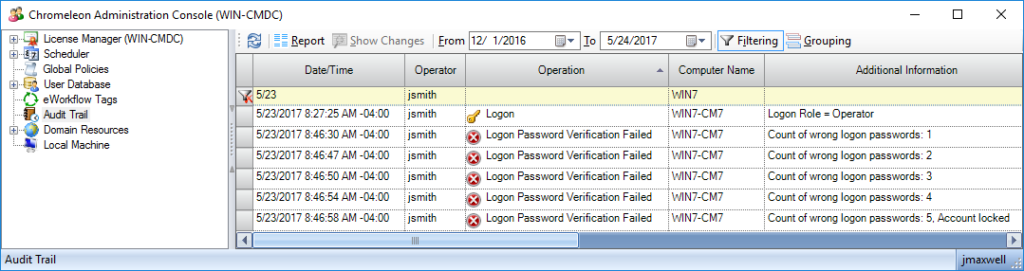
Рис. 3 Журнал аудита управления пользователями, в котором отображаются все попытки входа/выхода из системы, а также неудачные попытки доступа
Для отслеживаемости данных и любых изменений с ними важно наличие контрольных журналов (или audit trail) в программном обеспечении. Наличие таких журналов дает возможность обеспечивать соответствие данных принципам ALCOA+ и оперативно давать информацию в случае аудита или контроля.
Программное обеспечение Chromeleon имеет широкий спектр контрольных журналов, охватывающих очень много информации, что упрощает ее просмотр и интерпретирование.
Существуют журналы:
- аудита данных
- аудита инжекций
- аудита инструмента
- аудита конфигураций
- аудита управления пользователями
- аудита администрирования
В Chromeleon CDS «Журнал контроля версий и аудита данных» полностью задокументированы важные изменения и операции, выполняющиеся с конкретными объектами данных, такими как хранилища данных, последовательности, инжекции, методы обработки, инструментальные методы, шаблоны отчетов, библиотеки спектров и модифицированные хроматограммы. Кроме простого отслеживания изменений, он дает возможность просмотра несоответствий между двумя версиями объекта данных. Кроме того, более старая версия может быть восстановлена как текущая путем возвращения к более старой версии объекта данных.
Журнал аудита инжекций фиксирует всю информацию об активности прибора во время сбора необработанных данных (рис. 4).
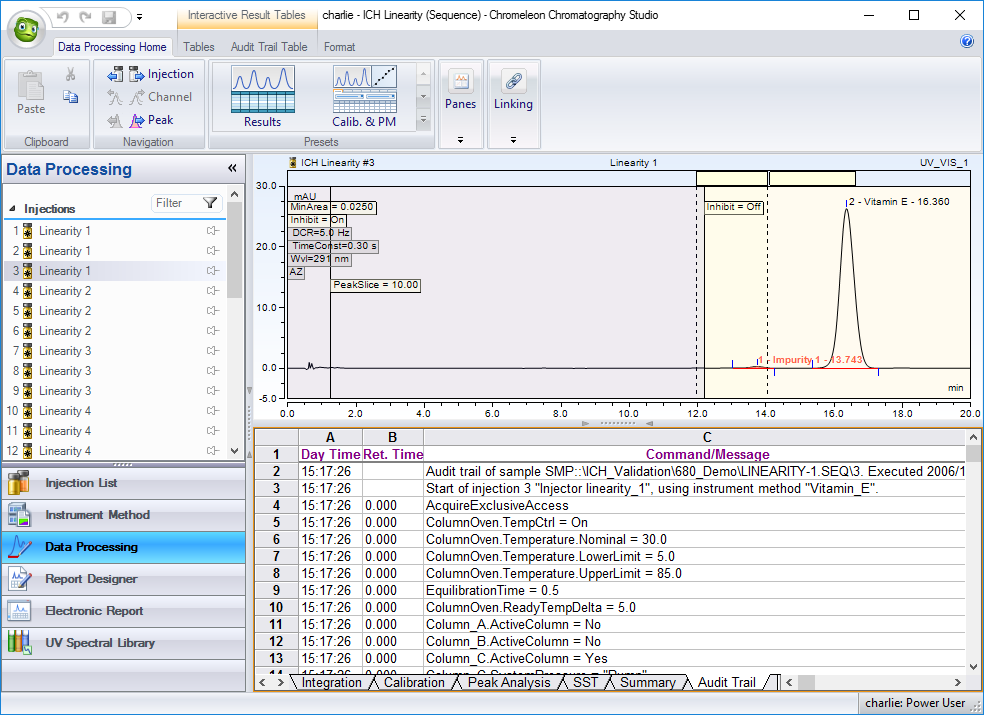
Рис. 4 Журнал аудита инжекцию фиксирует всю активность прибора
Согласно правил, изменения данных не должны скрывать предыдущую записанную информацию. В Chromeleon 7 CDS можно непосредственно сравнивать разные версии объекта, выделив две интересующие записи и выбрав «Показать изменения». Откроется диалоговое окно, в котором будет указано, где были внесены изменения, будет проведено прямое сравнение записей, показывающих старые и новые значения.
Журнал аудита конфигураций позволяет просматривать изменения конфигурации прибора (рис. 6)
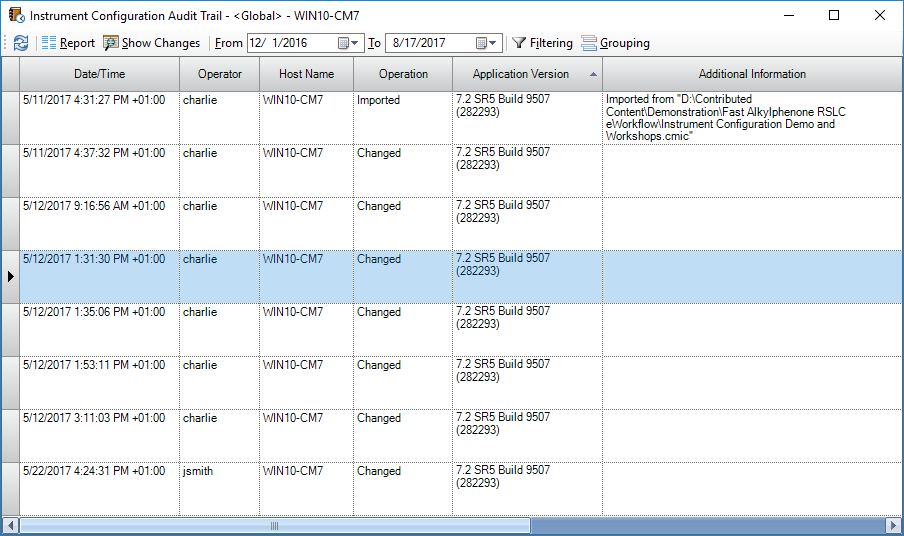
Рис.6 Журнал аудита конфигураций прибора
Все журналы аудита хранятся в одном месте и управляются в Chromeleon.
Особенностью Chromeleon являются инструменты квалификации прибора AutoQ. Этот инструмент предоставляет полный набор квалификационных процедур и является автоматизированным. Не нужно дополнительно покупать лицензии или проводить ручные манипуляции для квалификации – это всё включено в программное обеспечение (рис. 7).
Рис. 7 Инструмент квалификаций AutoQ
Целостность данных в основном зависит от корпоративной культуры, которая ценит качество продукции. Ответственность за обеспечение целостности данных распространяется на все уровни организации и бизнес-функции: от разработки продукта, производства и тестирования до распределения продукта и мониторинга безопасности.
Программное обеспечение Chromeleon предоставляет полноту, последовательность и точность данных, наличие и легкий доступ к комплексным журналам аудита, сохраняет аутентичность записи, предусматривает создание электронных отчетов с возможностью печати, электронную подпись и много других преимуществ.

Chromeleon имеет простой и интуитивно понятный интерфейс. Его функциональность соответствует регуляторным требованиям. Надо подчеркнуть, что удобный интерфейс необычайно важен для обеспечения целостности данных. Использование Chromeleon позволяет легко управлять системами, быстро и точно интерпретировать полученные результаты и быть уверенным в надежности хранения данных.
С программным обеспечением Chromeleon можно управлять не только хроматографами Thermo Fisher Scientific, но и системами других производителей (понадобится только дополнительная лицензия). Количество систем, которыми можно управлять с Chromeleon, определяется выбранной версией. Обновление между версиями и, например, количеством систем, которыми можно управлять с одного ПК, происходит просто и быстро. Также можно легко изменить программную прошивку на серверную версию с централизованным хранением данных и управлением с любого компьютера в лаборатории.
При возникновении вопросов или для получения более подробной информации – пишите на chromatography@alt.devbrainlab.com.ua


