Микросателлитная нестабильность (microsatellite instability, MSI) – это патологическое состояние клетки, при котором она имеет высокую склонность к мутациям вследствие нарушения работы механизмов репарации ошибочно спаренных нуклеотидов. 
В последние годы с динамичным развитием науки прецизионная медицина стала важной составляющей в подходах к лечению онкологических заболеваний в различных клинических учреждениях. Прецизионная онкология основывается на индивидуальном подходе в лечении, основанном на геномных и молекулярных исследованиях опухолей с определением их фенотипа, анализа анамнеза пациента и клинических данных, на основе которых устанавливается оптимальная стратегия лечения.
Система DNA mismatch repair
Система репарации ошибочно спаренных нуклеотидов представляет собой совершенно уникальный механизм выявления и устранения определенных нарушений и ошибок репликации ДНК (включение некомплементарных нуклеотидов, образование коротких делеций или инсерций и т.д.). В DNA mismatch repair системы входят полимеразы e, d и комплекс белков, среди которых наибольшее значение имеют MLH1, MSH2, MSH6 и PMS2. MMR работает не идеально, но все же распознает большинство дефектов в генетическом коде и устраняет их. Если белки репарации перестают нормально выполнять свои функции, частота нераспознанных мутаций резко возрастает – в сотни и тысячи раз. 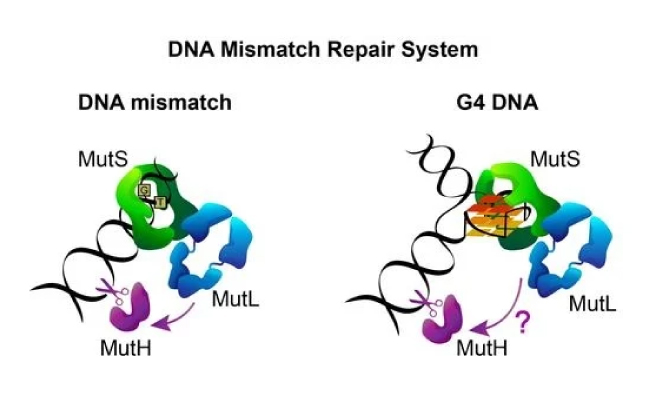
- наследственными мутациями в генах, кодирующих белки этой системы
- эпигенетическими изменениями, которые снижают активность генов, кодирующих MMR белки
История открытия MSI
Микросателлитная нестабильность была открыта в 70-80-х годах прошлого столетия. Первым заболеванием, с доказанным этиологическим фактором MSI стала пигментная ксеродерма – редкая наследственная патология, которая сопровождается повышением чувствительности кожи к ультрафиолетовому излучению и склонностью к развитию злокачественных опухолей. В 1993 году в научных журналах появились работы, в которых исследователи сообщали, что микросателлитная нестабильность часто встречается при злокачественных опухолях толстой и прямой кишки. С тех пор было проведено много исследований, посвященных этой теме. На данный момент известно, что нарушение системы репарации ДНК встречается при колоректальной карциноме в 15-20% случаев. Сейчас микросателлитная нестабильность официально признана как молекулярный маркер синдрома Линча (наследственная неполипозная колоректальная карцинома) – генетическое заболевание, при котором повышается риск развития рака толстой кишки в возрасте до 50 лет, а также рака яичников, тонкой кишки, желудка, кожи, мозга, мочевыводящих путей. Опухоли, которые возникают в результате микросателлитной нестабильности являются гипермутированными, они отличаются высокой мутационной нагрузкой, но вместе с тем они также накапливают большое количество неоантигенов, которые являются мишенями для иммунного ответа. Такие опухоли при гистологическом исследовании характеризуются интенсивной лимфоцитарной инфильтрацией, что свидетельствует об интенсивной воспалительной реакции. Оценка степени иммуногенности этих опухолей остается дискуссионным вопросом, требующим дополнительных исследований. В настоящее время описано, что иммуногенность опухолей с микросателлитной нестабильностью в 20-50 раз больше, чем у микросателлит-стабильных. Это свидетельствует о том, что опухоли с микросателлитной нестабильностью будут особенно восприимчивы к иммунотерапии.
Методы диагностики микросателлитной нестабильности
Самыми распространенными методами для диагностики микросателлитной нестабильности являются:
- иммуногистохимический метод
- ПЦР
- метод NGS
Иммуногистохимический метод диагностики MSI
ИГХ метод на сегодня является самым распространенным для диагностики MMR из-за относительной простоты использования, дешевизны и доступности. Для диагностики MMR в опухоли, в соответствии с международными рекомендациями, необходимо исследование 4 важнейших белков системы: MLH1, MSH2, MSH6 и PMS2. Классическим признаком положительной на микросателлитную нестабильность опухоли является парное “выпадение” белков, которые формируют комплекс системы, а именно: MLH1/PMS2 или MSH2/ MSH6. Однако также возможно большое количество вариаций, в частности дефицитом механизмов репарации неспаренных оснований ДНК (dMMR) считается наличие по крайней мере одного белка с потерей экспрессии. ИГХ метод доступен в большинстве диагностических гистологических лабораторий. Антитела к 4 белкам MSI системы от Leica Biosystems демонстрируют высокую специфичность и надежность.
Интерпретация результатов исследования имеет свои особенности:
- Реакция отсутствует: выраженное ядерное окрашивание в клетках опухоли. Интактной экспрессией MSI считается полное ядерное окрашивание во всех клетках опухоли с четким окрашиванием внутреннего контроля ткани, прилегающей к новообразованию (рис. 1А);
- Положительная реакция или полная потеря экспрессии: считается результат, при котором отсутствует или значительно уменьшено ядерное окрашивание в клетках опухоли по сравнению со смежной нормальной тканью, которая при этом демонстрирует четкое окрашивание (рис. 1В);
- Субклональная потеря экспрессии была определена как четко отграниченная региональная потеря ядерного окрашивания образцов опухоли с внутренней контрольной тканью, прилегающей к опухолевым клеткам, которая демонстрирует четкое окрашивание (рис. 1C). Субклональная потеря экспрессии MLH1 свидетельствует о том, что опухоль гетерогенна, то есть состоит из различных популяций клеток с различными генетическими характеристиками. В этом контексте, хотя некоторые клетки в опухоли могут сохранять экспрессию MLH1 и функциональный MMR, другие могут потерять экспрессию MLH1 из-за генетических или эпигенетических изменений. Эта неоднородность может иметь последствия для поведения опухоли, ответа на терапию и прогноза заболевания.
- «Двузначное окрашивание» это результат, при котором контрольные ткани и ткани опухоли имеют слабое окрашивание. Это означает, что результат нужно переделать (рис. 1D)
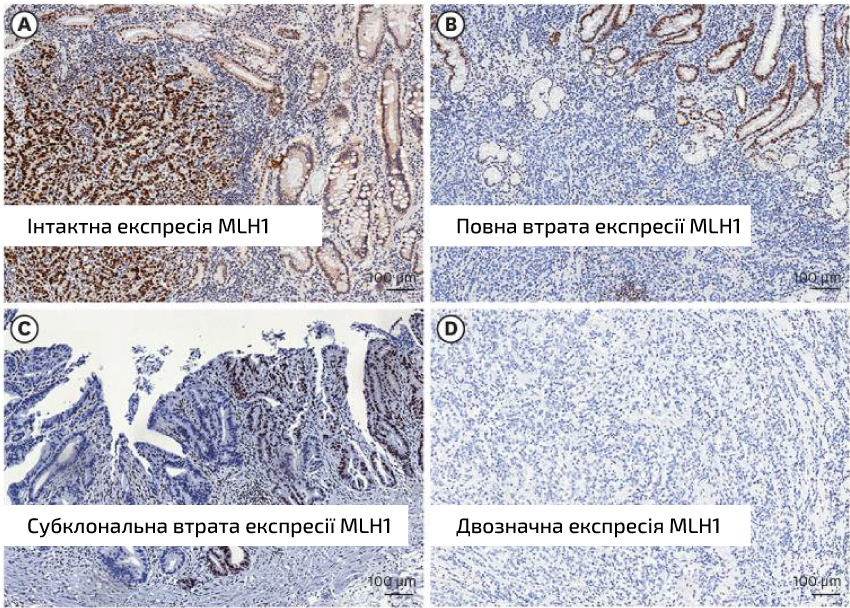
Рис. 1. Репрезентативные IHC изображения экспрессии белка MMR.
Все изображения сделаны с увеличением 100×. (взято с: Park Y, Nam SK, Seo SH, Park KU, Oh HJ, Park YS, Suh YS, Ahn SH, Park DJ, Kim HH, Lee HS. Comprehensive Study of Microsatellite Instability Testing and Its Comparison With Immunohistochemistry in Gastric Cancers. J Gastric Cancer. 2023 Apr;23(2):264-274. doi: 10.5230/jgc.2023.23.e5. PMID: 37129151; PMCID: PMC10154139.)
Доказано, что этап поиска антигена является критически важным для правильной интерпретации статуса пациента. Часто некорректное связывание антитела с антигеном при проведении ИГХ приводит к слабому окрашиванию и низкой специфичности для LS (в то время, как высокое фоновое окрашивание также связано с плохой чувствительностью). Иногда встречаются слабые или гетерогенные модели окрашивания, которые могут быть связаны с вариациями в фиксации ткани или слабыми антителами. В этих случаях может быть полезным повторное проведение IHC с использованием качественной системы детекции. Антитела для диагностики микросателлитной нестабильности от Leica Biosystems официально рекомендованы Управлением по контролю за продуктами и лекарствами США – FDA. Панель антител MMR Leica Biosystems MLH1, MSH2, MSH6 и PMS2 была признана качественной и высокочувствительной для диагностики при проведении иммуногистохимического окрашивания залитых в парафин образцов тканей человека. Высокое качество полученных результатов подтверждается рекомендациями FDA, клиническим опытом лабораторий и научных учреждений Европы, Америки и Украины.
Ссылки на источники:
- Watkins JC, Nucci MR, Ritterhouse LL, Howitt BE, Sholl LM. Unusual mismatch repair immunohistochemical patterns in endometrial carcinoma. Am J Surg Pathol. 2016;40:909–916.
- Sari A, Pollett A, Eiriksson LR, Lumsden-Johanson B, Van de Laar E, Kazerouni H, et al. Interobserver agreement for mismatch repair protein immunohistochemistry in endometrial and nonserous, nonmucinous ovarian carcinomas. Am J Surg Pathol. 2019;43:591–600.
- Park Y, Nam SK, Seo SH, Park KU, Oh HJ, Park YS, Suh YS, Ahn SH, Park DJ, Kim HH, Lee HS. Comprehensive Study of Microsatellite Instability Testing and Its Comparison With Immunohistochemistry in Gastric Cancers. J Gastric Cancer. 2023 Apr;23(2):264-274. doi: 10.5230/jgc.2023.23.e5. PMID: 37129151; PMCID: PMC10154139.
- Hargadon KM, Johnson CE, Williams CJ. Immune checkpoint blockade therapy for cancer: an overview of FDA-approved immune checkpoint inhibitors. Int Immunopharmacol. 2018;62:29–39.
- Praveen Vikas et al., Mismatch Repair and Microsatellite Instability Testing for Immune Checkpoint Inhibitor Therapy: ASCO Endorsement of College of American Pathologists Guideline. JCO 41, 1943-1948(2023). DOI:10.1200/JCO.22.02462
