Существует несколько форматов, используемых для ИФА. Они делятся на прямые, непрямые и многослойные методы захвата и детекции. Ключевым этапом является иммобилизация интересующего антигена, которая осуществляется либо путем прямой адсорбции на планшете, либо косвенно, через антитело захвата, прикрепленное к планшету. Затем антиген обнаруживается либо напрямую (меченое первичное антитело), либо косвенно (например, меченое вторичное антитело). Наиболее широко используемый ИФА метод – многослойный ИФА анализ, который непрямо иммобилизует и непрямо определяет присутствие целевого антигена. Этот тип анализа называется еще «сэндвич»-анализом, поскольку измеряемый аналит связывается между двумя первичными антителами, каждое из которых определяет свой эпитоп антигена – антителом захвата и антителом детекции. Сэндвич-метод ИФА широко используется благодаря своей чувствительности и специфичности.
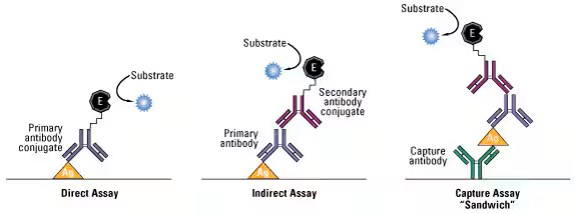
Диаграмма распространенных методов ИФА. В этом анализе интересующий антиген иммобилизуется путем прямой адсорбции на пластине или путем предварительного прикрепления антитела захвата к поверхности пластины. Затем антиген может быть обнаружен с помощью конъюгированного с ферментом первичного антитела (прямое определение) или набора немеченых первичных и конъюгированных вторичных антител (непрямое определение).