Во-первых не навреди!
Основной целью множества исследований в клеточной биологии является достижение полного сохранения неизменными физических и биохимических характеристик клеток на протяжении всего процесса их анализа. Приготовление минимальных количеств образцов и тщательные манипуляции с ними помогают ученым и исследователям быть уверенными в том, что они работают с нативным состояние клетки, а не с артефактом возникшим впоследствии использования обширных протоколов, методик и поправок к ним. Так как проточный цитометр со стандартной гидродинамической фокусировкой не позволяет работать с малыми и сверхмалыми объемами образцов – провести своевременный и качественный анализ без обогащения протоколов выделения/анализа клеток без изменения их фенотипических характеристик не представляется возможным. Как и сохранение популяции редких клеточных типов [i].
В отличие от гидродинамической фокусировки, акустическая фокусировка проточного цитометра Attune NxT позволяет анализировать большие объемы образца (до 1000 мкл / мин) без каких-либо потерь в разрешении данных, тем самым уменьшая необходимость обогащения суспензии клеток и позволяя улавливать редкие события в гетерогенной их популяции. Кроме того, образцы, трудно поддающиеся забору, такие как кровь мыши, образцы костного мозга или аспираты полученные с помощью тонкой иглы – могут быть окрашены и разведены для анализа без промывки или дальнейшего лизиса эритроцитов.
Преимущества акустической фокусировки при анализе популяций редких клеток
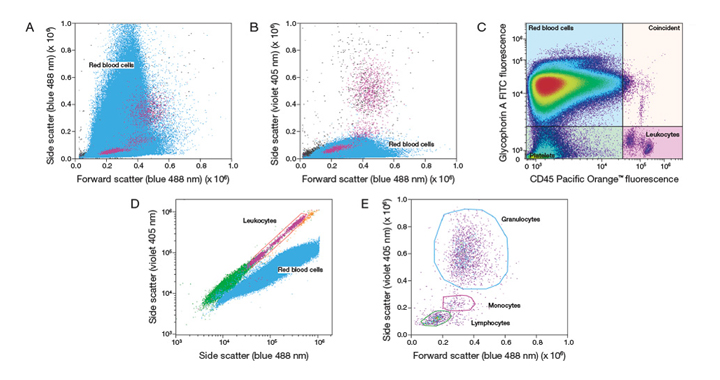
В цельной крови человека эритроциты превышают количество лейкоцитов в соотношении ~ 1000 к 1. Этот дисбаланс создает два препятствия при попытке проанализировать лейкоциты в образцах цельной крови без проведения дополнительных манипуляций с образцом: (1) сбор достаточного количества лейкоцитарных событий, чтобы иметь статистически значимые данные, и (2) отделение лейкоцитов от красных кровяных клеток. На рис. 1А показан обычный профиль цельной крови при 488 нм боковом рассеивании (SSC) против прямого рассеивания (FSC) – два типа клеток не могут быть разделены;
Рис. 1В показывает улучшенное разрешение двух типов клеток, когда используется фиолетовое SSC 405 нм.
Стандартные методы выделения и обнаружения лейкоцитов в цельной крови человека отнимают много времени и часто включают в себя значительное обогащение полученной суспензии клеток и всевозможные манипуляции с ней перед анализом. Эти процедуры подготовки пробы могут привести к изменениям в клеточной физиологии и потере типов клеток, представляющих интерес [ii]. Во избежание манипуляций с образцом, обогащение артефактов и медленного анализа, мы разработали три различных no–lyse, no–wash протокола для идентификации лейкоцитов в цельной крови человека на Attune ™ NXT, а также no–lyse, no–wash тест для изучения и анализа фагоцитарной функции клеток.
 |
|
Рисунок 1. Идентификация лейкоцитов в цельной крови человека с помощью фиолетового бокового рассеивания на проточном цитометре с акустической фокусировкой Attune ™ NXT. (A) Использование обычного прямого рассеивания (синий 488 нм) рассеяния (FSC) и бокового рассеяния (SSC) не позволяет отделить лейкоциты от общей массы цельной крови. Backgate-анализ с использованием флуоресцентно меченых антител, специфичных для лейкоцитов (розовый) и красных кровяных телец (синий) наглядно демонстрирует эту проблему. (В) Визуальное отделение лейкоцитов из красных кровяных телец в цельной крови улучшается за счет включения фиолетового (405 нм) SSC с помощью набора фильтров Attune ™ NxT No–Wash, No–lyse. (С) Backgate– анализ с использованием антител против маркера красных кровяных клеток гликофорина А и антител против лейкоцитарного маркера CD45 демонстрирует легкость идентификации лейкоцитов в цельной крови человека, в отличие от FSC и SSC анализов изображенных на (А) и (В). (D) Использование как фиолетового так и синего SSC позволяет идентифицировать лейкоциты в цельной крови, что подтверждается backgate-анализом с использованием маркеров гликофорина А и CD45 как показано на изображении (С), и демонстрирует различные разброс свойств лейкоцитов и эритроцитов в крови при использовании фиолетового SSC. (Е) Когда лейкоциты гейтируются на основании способности рассеивать фиолетовый свет – выделяются следующие три основные популяции лейкоцитов в крови человека: лимфоциты, моноциты, гранулоциты. |
Три no–lyse, no–wash протокола по детекции лимфоцитов
Первичный подход к детекции лейкоцитов основывается на разнице в рассеивании света красными клетками крови и лейкоцитами. Эритроциты, как известно, содержат гемоглобин, молекулу, способную легко абсорбировать излечение фиолетового лазера (405 нм) в то время как лейкоциты на это не способны (Рис 1B), что в результате означает создание уникального спектра рассеивания человеческой цельной крови при использовании синего (488 нм) и фиолетового (405 нм) источников света [iii]. Использование набора фильтров Attune™ NxT No–Wash No–Lyse Filter Kit на акустическом проточном цитометре the Attune™ NxT Acoustic Focusing Cytometer позволяет одновременно использовать и синий, и фиолетовый лазеры (SSC) и дифференциировать эритроциты и лейкоциты основываясь только на их светорассеивающих свойствах (Рис 1D). Этот метод валидирован производителем с использованием флуоресцентно-меченных CD45-экспрессирующих лейкоцитов или гликофорин А-экспрессирующих эритроцитов (Рис 1C). Далее лейкоциты могут быть диференциированны пользователем на гранулоциты, моноциты и лимфоциты гейтированием популяции лейкоцитов и отделением зоны фиолетового SSC vs. синего FSC (Рис 1E).
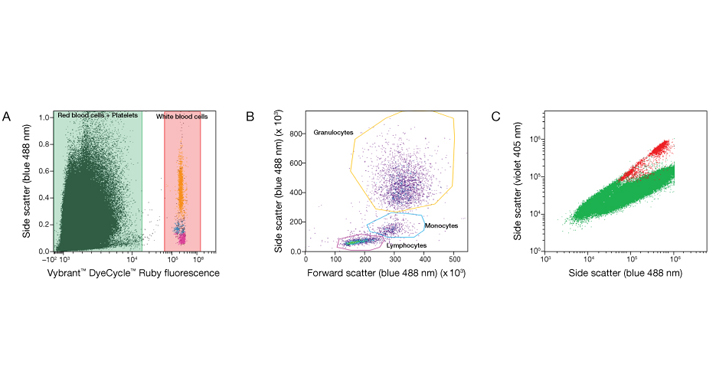
Следующих два no–lyse, no–wash подхода включают использование флуоресцентных маркеров специфичных к поверхностным маркерам экспрессируемым на поверхности эритроцитов или лейкоцитов. Например, эритроциты экспрессируют гликофорин A а лейкоциты, в свою очередь, экспрессируют CD45. Т.к. представление этих двух маркеров является взаимоисключающим, то флюорофор-коньюгированные антитела, распознающие эти два маркера, позволяют предельно точно идентифицировать/отделить красные клетки крови от белых (Рис 1C). Альтернативным путем может быть использование ДНК красителей Vybrant™ DyeCycle™ которые связываются непосредственно с нуклеиновыми кислотами. Т.к созревшие эритроциты безъядерные, а лейкоциты имеют клеточное ядро – окрашивание одним из красителей группы Vybrant™ DyeCycle™ естественным образом визуально отделяет два типа клеток (Рис 2).
 |
|
Рис 2. Идентификация лейкоцитов в образцах человеческой цельной крови с использованием красителей Vybrant™ DyeCycle™ на проточном цитометре Attune™ NxT. Проникающий сквозь мембрану краситель Vybrant™ DyeCycle™ метит живые нуклеарные клетки делая, таким образом, возможным идентификацию лейкоцитов. (A) Образец цельной крови был помечен Vybrant™ DyeCycle™ Ruby Stain для идентификации лейкоцитов по связыванию красителя с ДНК. (B) Анализ свойств синего переднего рассеивания (FSC) и бокового рассеивания (SSC) клетками помеченными Vybrant™ DyeCycle™ Ruby Stain позволяет распознать три основные популяции лейкоцитов в человеческой крови: лимфоциты, моноциты, гранулоциты. (C) Использование Attune™ NxT No–Wash No–Lyse Filter Kit с фиолетовым рассеиванием подтверждает данные полученные с использованием Vybrant™ DyeCycle™ Ruby Stain по идентификации лейкоцитов человеческой крови. |
No–lyse, no–wash наборы для определения субпопуляций фагоцитирующих клеток
Thermo Fisher Scientific разработал фукциональные no–lyse, no–wash наборы с использованием коньюгатов pHrodo™ E. coli BioParticles™ для оценки функций фагоцитов в цельной крови человека с использованием акустического цитометра Attune™ NxT. Фагоцитирующие клетки — такие как нейтрофилы и моноциты — являются ключевыми компонентами имунной системы, выступая критически важной линией защиты от вторжения патогенных микроорганизмов [iv]. Моноциты созревают до макрофагов или дендритных клеток в зависимости от поступившего стимулирующего сигнала [v]. Характеристика функциональных возможностей этих фагоцитирующих клеточных линий в цельной крови с помощью no–lyse, no–wash наборов значительно экономит время и снижает количество вероятных артефактов, которые могут появится при лизисе красных клеток крови и множественной очистке, центрифугировании, этапах отмывки. Более того, минимальный объем используемого образца и короткий период аквизиции позволяет сохранять жизнеспособность клеток при мультиплексировании.
В no–lyse, no–wash наборах для исследования фагоцитоза предусмотрена инкубация цельной крови с коньюгатом pHrodo™ Green E. coli BioParticles™ от 15 до 30 мин, а затем мечение клеток красителем Vybrant™ DyeCycle™ Ruby Stain, красителем проникающим в клетку и связывающимся с нуклеиновыми кислотами. pHrodo™ BioParticles™ коньюгаты это инактивированные бактерии (E. coli или S. aureus) или дрожжевой зимозан (из S. cerevisiae) маркированные красителями марки pHrodo™ — pH сенсорами, не флуоресцирующими при нейтральном pH и проявляющими флуоресценцию когда рH становится более кислым. Фагоциты, поглотившие (pH ~5) коньюгаты pHrodo™ Green или pHrodo™ Red BioParticles флуоресциируют соответсвующе, и данное поглощение ингибируется при температуре 4°C.
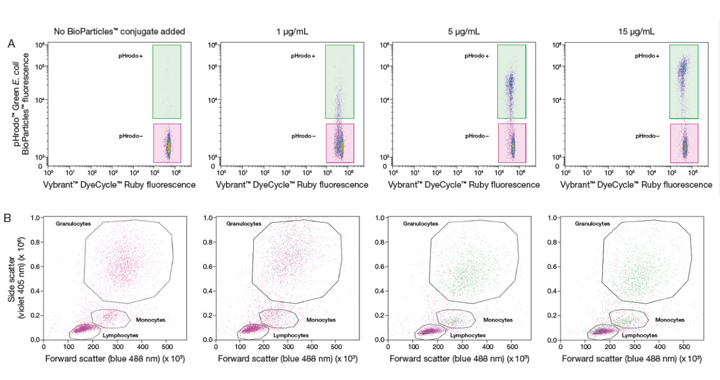
На Рис 3A видно, что при повышении концентрации коньюгатов pHrodo™ BioParticles™ повышается также частота встречаемости фагоцитов позитивных по красителю pHrodo™. Более того, данные полученные при дозозависимых измерениях совместно с данными по гейтированию фиолетового SSC vs. синего FSC предельно просто выделяют три мажорные субпопуляции лейкоцитов — гранулоциты, моноциты и лимфоциты (Рис 3B). При концентрациях коньюгата рHrodo™ BioParticles™ ≤5 мкг/мл нейтрофилы (в рамках популяции гранулоцитов) и моноциты являются первичными фагоцитирующими клетками. При повышении концентрации коньюгата pHrodo™ BioParticles™ большее количество нейтрофилов и моноцитов показывают позитивный pHrodo™ сигнал.
 |
|
Рис 3. Графическое отображение дозо-зависимого ответа на коньюгат pHrodo™ Green E. coli BioParticles™ показывает множественные типы фагоцитирующих клеток в человеческой цельной крови при использовании набора no–lyse, no–wash. Цельная кровь инкубировалась с 1, 5, или 15 мкг/мл коньюгата pHrodo™ Green E. coli BioParticles™ или оставалась необработанной реактивом на 30 мин при 37°C в 5% CO2, разведенная, а потом метилась красителем Vybrant™ DyeCycle™ Ruby Stain в течении 15 мин при температуре 37°C в 5% CO2. (A) При повышении концентрации коньюгата pHrodo™ Green BioParticles™ частота встречаемости фагоцитирующих клеток позитивных по pHrodo™ повышается наряду с изменениями интенсивности зеленой флуересценции (MFI) при больших концентрациях коньюгата pHrodo™ Green BioParticles™. (B) При использовании коньюгата pHrodo™ Green BioParticles™ в концентрации 15 мкг/мл очевидно, что среди гейтированых гранулоцитов, моноцитов, лимфоцитов существуют субпопуляции активно захватывающие коньюгат pHrodo™ (выделено зеленым). |
Мультиплексное определение событий на Attune™ NxT цитометре
При использовании 4х лазеров, 16 детекционных каналов в работе на акустическом цитометре Attune™ NxT наборы no–lyse, no–wash могут быть мультиплексированы реагентикой Molecular Probes™ с целью идентификаций редких событий, уникальных типов клеток и изменений их функционирования.
